Liên kết hydrogen có phải là sự xen phủ giữa các orbital? Giải thích và cho ví dụ minh họaLiên kết hydrogen không phải là sự xen phủ giữa các AO, mà chỉ là lực
111
31/01/2024
Bài OT3.8 trang 42 SBT Hóa học 10: Liên kết hydrogen có phải là sự xen phủ giữa các orbital? Giải thích và cho ví dụ minh họa.
Trả lời
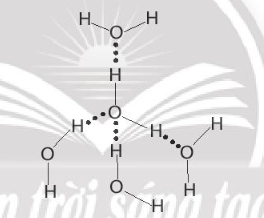
Liên kết hydrogen không phải là sự xen phủ giữa các AO, mà chỉ là lực hút tĩnh điện giữa nguyên tử hydrogen mang một phần điện tích dương đã liên kết với một nguyên tử có độ âm điện lớn (thường là N, O, F) với một nguyên tử có độ âm điện lớn khác (thường là N, O, F).
Ví dụ liên kết hydrogen giữa các phân tử nước:
Xem thêm các bài giải sách bài tập Hóa học lớp 10 , chi tiết khác
Bài 10: Liên kết cộng hóa trị
Bài 11: Liên kết hydrogen và tương tác van der waals
Ôn tập chương 3
Bài 12: Phản ứng oxi hóa – khử và ứng dụng trong cuộc sống
Ôn tập chương 4
Bài 13: Enthalpy tạo thành và biến thiên enthalpy của phản ứng hóa học

