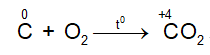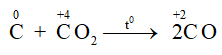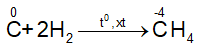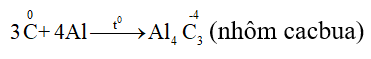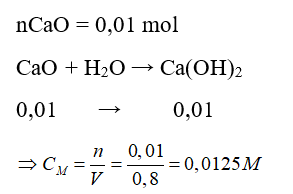Phản ứng CaO + C → CaC2 + CO
1. Phương trình CaO ra CaC2
CaO + 3C CaC2 + CO
2. Điều kiện phản ứng xảy ra CaO ra CaC2
Nhiệt độ cao: 2000oC
Canxi oxit phản ứng với cacbon thu được canxi cacbua và khí CO thoát ra.
3. Bản chất của các chất tham gia phản ứng
3.1. Bản chất của CaO (Canxi oxit)
Trong phản ứng trên CaO là chất oxi hoá.
3.2. Bản chất của C (Cacbon)
- Trong phản ứng trên C là chất khử.
- Các oxit của kim loại đứng sau Al trong dãy hoạt động hóa học bị C khử ở nhiệt độ cao.
4. Kiến thức mở rộng
Canxi cacbua hay còn gọi là đất đèn.
4.1. Sản xuất Canxi cacbua trong công nghiệp
Ở quy mô công nghiệp, Canxi cacbua được sản xuất trong các lò hồ quang ở nhiệt độ 2000oC, nguyên liệu là vôi sống và than cốc.
CaO + 3C → CaC2+ CO
Đất đèn được tạo ra ở nhiệt độ rất cao, khoảng 2000oC, nhiệt độ này không dễ tạo ra bằng phương pháp gia nhiệt truyền thống (bằng than hoặc củi). Vì vậy, phản ứng phải được thực hiện trong lò hồ quang với các thanh điện cực bằng than chì.
4.2. Công dụng của đất đèn
-
Sản xuất đất đèn ra axetilen
Phản ứng của đất đèn với nước là quá trình sản xuất ra axetilen và canxi hydroxit, theo công thức:
Phản ứng này là cơ sở của việc sản xuất axetylen công nghiệp và cũng là công dụng chính của đất đèn.
Ở nhiệt độ cao, Canxi cacbua phản ứng với hơi nước để tạo ra canxi cacbonat, carbon dioxide và hydro.
Chủ yếu ngày nay axetilen được sản xuất bằng cách đốt một phần khí methane hoặc như một sản phẩm phụ xuất hiện trong dòng ethylene từ sự nứt vỡ của các hydrocacbon.
5. Tính chất hóa học của C
- Trong các dạng tồn tại của C, C vô định hình hoạt động hơn cả về mặt hóa học.
- Trong các phản ứng hóa học C thể hiện hai tính chất: Tính oxi hóa và tính khử. Tuy nhiên tính khử vẫn là chủ yếu của C.
5.1. Tính khử
- Tác dụng với oxi
Ở nhiệt độ cao C lại khử CO2 theo phản ứng:
- Tác dụng với oxit kim loại:
+ C khử được oxit của các kim loại đứng sau Al trong dãy hoạt động hóa học của kim loại:
CuO + C → Cu + CO (tº)
Fe2O3 + 3C → 2Fe + 3CO (tº)
+ Với CaO và Al2O3:
CaO + 3C → CaC2 + CO (trong lò điện)
2Al2O3 + 9C → Al4C3 + 6CO (2000ºC)
- Tác dụng với các chất oxi hóa mạnh thường gặp H2SO4 đặc, HNO3, KNO3, KClO3, K2Cr2O7, ... trong các phản ứng này, C bị oxi hóa đến mức +4 (CO2).
C + 2H2SO4 đặc → CO2 + 2SO2 + 2H2O (tº)
C + 4HNO3 đặc → CO2 + 4NO2 + 2H2O (tº)
C + 4KNO3 → 2K2O + CO2 + 4NO2 (tº)
- Khi nhiệt độ cao, C tác dụng được với hơi nước:
C + H2O → CO + H2 (1000ºC)
C + 2H2O → CO2 + 2H2
5.2. Tính oxi hóa
- Tác dụng với hidro
- Tác dụng với kim loại
6. Bài tập vận dụng
Câu 1. Khi cho CaO vào nước thu được
A. dung dịch CaO.
B. dung dịch Ca(OH)2.
C. chất không tan Ca(OH)2.
D. cả B và C.
Lời giải:
Đáp án: D
Khi cho CaO vào nước xảy ra phản ứng: CaO + H2O → Ca(OH)2
Vì Ca(OH)2 là chất ít tan trong nước, phần tan tạo thành dung dịch bazơ và còn 1 phần không tan lắng xuống
Câu 2. Vôi sống có công thức hóa học là:
A. CaO
B. Ca(OH)2
C. CaCO3
D. Ca(HCO3)2
Lời giải:
Đáp án: A
Câu 3. Hóa chất nào sau đây dùng để khử chua đất trong công nghiệp?
A. CaCO3.
B. MgCO3.
C. NaCl.
D. CaO.
Lời giải:
Đáp án: D
Đất chua là đất có môi trường axit => dùng hóa chất có tính bazơ để trung hòa bớt độ chua của đất
CaO + H2O → Ca(OH)2 (môi trường bazơ)
Ca(OH)2 trung hòa lượng H+ trong đất làm đất bớt chua
Câu 4. Canxi oxit có thể tác dụng được với những chất nào sau đây?
A. H2O, CO2, HCl, H2SO4.
B. CO2, HCl, NaOH, H2O.
C. Mg, H2O, NaCl, NaOH.
D. CO2, HCl, NaCl, H2O.
Lời giải:
Đáp án: A
Canxi oxit có thể tác dụng được với : H2O, CO2, HCl, H2SO4.
Câu 5. Các oxit tác dụng được với nước là
A. PbO2, K2O, SO3.
B. BaO, K2O, SO2.
C. Al2O3, NO, SO2.
D. CaO, FeO, NO2.
Lời giải:
Đáp án: B
Các oxit tác dụng được với nước là BaO, K2O, SO2.
BaO + H2O → Ba(OH)2
K2O + H2O → 2KOH
SO2 + H2O ⇆ H2SO3
Câu 6. Ứng dụng nào sau đây không phải của canxi oxit?
A. Công nghiệp sản suất cao su
B. Sản xuất thủy tinh.
C. Công nghiệp xây dựng, khử chua cho đất.
D. Sát trùng diệt nấm, khử độc môi trường.
Lời giải:
Đáp án: A
CaO được dùng trong công nghiệp sản xuất thủy tinh; khử chua đất trồng trọt; xử lí nước thải của các nhà máy.
=> Ứng dụng không phải của canxi oxit là: công nghiệp luyện kim
Câu 7. BaO tác dụng được với các chất nào sau đây?
A. H2O, NO, KOH.
B. NaOH, SO3, HCl.
C. P2O5, CuO, CO.
D. H2O, H2CO3, CO2.
Lời giải:
Đáp án: D
BaO tác dụng được với: H2O, H2CO3, CO2.
BaO + H2O → Ba(OH)2
BaO + H2CO3 → BaCO3 + H2O
BaO + CO2 → BaCO3
Loại A vì BaO không phản ứng với KOH
Loại B vì BaO không phản ứng với NaOH
Loại C vì BaO không phản ứng với CO.
Câu 8. Lưu huỳnh trioxit (SO3) tác dụng được với:
A. Nước, sản phẩm là bazơ.
B. Axit, sản phẩm là bazơ.
C. Nước, sản phẩm là axit.
D. Bazơ, sản phẩm là axit.
Lời giải:
Đáp án: C
SO3 là oxit axit
=> tác dụng với nước cho sản phẩm là axit và tác dụng với bazo cho sản phẩm là muối
Câu 9. Một loại đá vôi chứa 80% CaCO3. Nung 1 tấn đá vôi loại này có thể thu được bao nhiêu kg vôi sống (CaO), nếu hiệu suất là 85%?
A. 308,8 kg.
B. 388,8 kg.
C. 380,8 kg.
D. 448,0 kg.
Lời giải:
Đáp án: C
1 tấn đá vôi chứa 80% CaCO3 => mCaCO3 = 0,8 tấn = 800 kg
CaCO3 → CaO + CO2
100 kg → 56 kg
800 kg → 448 kg
Vì hiệu suất là 85% => mCaO thực tế = 448.85% = 380,8 kg
Câu 10. Hòa tan 0,56 gam CaO vào 800 ml nước thu được dung dịch nước vôi trong có nồng độ mol là
A. 0,15M.
B. 0,0125M.
C. 0,015M.
D. 0,0025M.
Lời giải:
Đáp án: B
Xem các phương trình hoá học khác:
CaO + H2O → Ca(OH)2 | CaO ra Ca(OH)2
CaO + HCl → CaCl2 + H2O | CaO ra CaCl2
CaCO3 → CaO + CO2 | CaCO3 ra CaO | CaCO3 ra CO2