Trắc nghiệm Hóa học 10 Bài 9. Liên kết ion có đáp án
Trắc nghiệm Hóa học 10 Bài 9. Liên kết ion có đáp án
-
79 lượt thi
-
15 câu hỏi
-
0 phút
Danh sách câu hỏi
Câu 1:
Khẳng định đúng là
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Khi nhường electron, nguyên tử trở thành ion dương (cation)
Khi nhận electron, nguyên tử trở thành ion âm (anion)
Giá trị điện tích trên cation hoặc anion bằng số electron mà nguyên tử đã nhường hoặc nhận.
Câu 2:
Liên kết ion thường được hình thành khi
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Liên kết ion thường được hình thành khi kim loại điển hình tác dụng với phi kim điển hình.
Câu 3:
Liên kết ion trong hợp chất KCl tạo bởi lực hút tĩnh điện giữa
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
K (Z = 19): [Ar]4s1⇒ có 1 electron lớp ngoài cùng ⇒ xu hướng nhường 1 electron để trở thành caction K+
Cl (Z = 17): [Ne]3s23p5⇒ có 7 electron lớp ngoài cùng ⇒ xu hướng nhận 1 electron để trở thành anion Cl−
Liên kết ion trong hợp chất KCl tạo bởi lực hút tĩnh điện giữa cation K+ và anion Cl−.
Câu 4:
Phát biểu nào sau đây là đúng?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Liên kết ion được hình thành bởi lực hút tĩnh điện giữa ion dương (hình thành từ kim loại) và ion âm (hình thành từ phi kim).
⇒ Phân tử chứa liên kết ion được hình thành từ kim loại và phi kim điển hình.
⇒ Liên kết ion chỉ có trong hợp chất.
Câu 5:
Quá trình hình thành liên kết ion trong phân tử MgO là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Mg (Z = 12): [Ne]3s2có 2 electron lớp ngoài cùng ⇒ xu hướng nhường 2 electron để đạt cấu hình electron lớp ngoài cùng bền vững của khí hiếm.
O (Z = 8): [He]2s22p4có 6 electron lớp ngoài cùng ⇒ xu hướng nhận 2 electron để đạt cấu hình electron lớp ngoài cùng bền vững của khí hiếm.
Quá trình hình thành liên kết ion:
Mg ⟶ Mg2++ 2e
[Ne]3s2[Ne]
O + 2e ⟶ O2−
[He]2s22p4[Ne]
Mg2+ + O2−⟶ MgO
Câu 6:
Quá trình hình thành liên kết ion trong phân tử CaCl2 là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Ca (Z = 20): [Ar]4s2có 2 electron lớp ngoài cùng ⇒ xu hướng nhường 2 electron để đạt cấu hình electron lớp ngoài cùng bền vững của khí hiếm.
Cl (Z = 17): [Ne]3s23p5có 7 electron lớp ngoài cùng ⇒ xu hướng nhận 1 electron để đạt cấu hình electron lớp ngoài cùng bền vững của khí hiếm.
Quá trình hình thành liên kết ion:
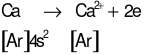
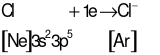
Ca2+ + 2Cl−⟶ CaCl2
Câu 7:
Ion Al3+có cấu hình electron giống cấu hình electron của khí hiếm nào?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
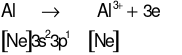
Al (Z = 13): [Ne]3s23p1có 3 electron lớp ngoài cùng ⇒ xu hướng nhường 3 electron để đạt cấu hình electron lớp ngoài cùng bền vững của khí hiếm gần nhất là Ne.
Câu 8:
Cho các ion sau: Ca2+, F−, Al3+và P3−. Số ion có cấu hình electron của khí hiếm neon là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Ca (Z = 20): [Ar]4s2có 2 electron lớp ngoài cùng ⇒ xu hướng nhường 2 electron để đạt cấu hình electron lớp ngoài cùng bền vững của khí hiếm gần nhất là Ar.
⇒ Cấu hình electron của Ca2+là: [Ar]
F (Z = 9): 1s22s22p5có 7 electron lớp ngoài cùng ⇒ xu hướng nhận 1 electron để đạt cấu hình electron lớp ngoài cùng bền vững của khí hiếm gần nhất là Ne.
⇒ Cấu hình electron của F−là: [Ne]
Al (Z = 13): [Ne]3s23p1có 3 electron lớp ngoài cùng ⇒ xu hướng nhường 3 electron để đạt cấu hình electron lớp ngoài cùng bền vững của khí hiếm gần nhất là Ne.
⇒ Cấu hình electron của Al3+là: [Ne]
P (Z = 15): [Ne]3s23p3có 5 electron lớp ngoài cùng ⇒ xu hướng nhận 3 electron để đạt cấu hình electron lớp ngoài cùng bền vững của khí hiếm gần nhất là Ar.
⇒ Cấu hình electron của P3−là: [Ar]
Vậy có 2 ion có cấu hình electron của khí hiếm neon.
Câu 9:
So sánh nào dưới đây là đúng?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Nguyên tử Ca (Z = 20): [Ar]4s2có 4 lớp electron.
Ca ⟶ Ca2++ 2e
Ion Ca2+(Z = 20): [Ar] có 3 lớp electron.
Do đó bán kính nguyên tử Ca lớn hơn bán kính ion Ca2+
Câu 10:
Hợp chất nào dưới đây là hợp chất ion?
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Hợp chất ion là hợp chất được hình thành từ kim loại điển hình với phi kim điển hình.
Na là kim loại điển hình, Cl là phi kim điển hình ⇒ NaCl là hợp chất ion.
Câu 11:
Cho các tính chất dưới đây:
(i) Dẫn điện ở trạng thái rắn.
(ii) Dễ tan trong nước tạo thành dung dịch có khả năng dẫn điện.
(iii) Thường tồn tại ở thể rắn trong điều kiện thường.
(iiii) Dễ nóng chảy, dễ bay hơi.
Số tính chất điển hình đúng của hợp chất ion là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Tính chất điển hình của hợp chất ion là
(i) Dẫn điện ở trạng thái rắn. ⇒ sai vì không dẫn điện ở trạng thái rắn.
(ii) Dễ tan trong nước tạo thành dung dịch có khả năng dẫn điện. ⇒ đúng
(iii) Thường tồn tại ở thể rắn trong điều kiện thường. ⇒ đúng
(iiii) Dễ nóng chảy, dễ bay hơi. ⇒ sai vì khó nóng chảy, khó bay hơi.
Vậy có 2 tính chất đúng.
Câu 12:
Anion X3- có cấu hình electron 1s22s22p63s23p6. Cấu hình electron nguyên tử của X là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Anion X3−có cấu hình electron 1s22s22p63s23p6
Mà X + 3e → X3−
Nên cấu hình electron nguyên tử của X là 1s22s22p63s23p3.
Câu 13:
Ở điều kiện thường, các hợp chất ion thường tồn tại ở dạng
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Ở điều kiện thường, các hợp chất ion thường tồn tại ở dạng tinh thể rắn.
Câu 14:
Liên kết ion là loại liên kết phổ biến trong
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Liên kết ion là loại liên kết phổ biến trong các hợp chất được tạo nên từ kim loại điển hình và phi kim điển hình.
Câu 15:
Công thức của hợp chất ion được hình thành từ anion Y2− và cation X+ là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Tổng điện tích của các ion trong hợp chất ion bằng 0.
Giả sử công thức có dạng: XaYb
Khi đó: 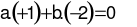 ⇒
⇒ 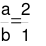 . ⇒ a = 2 và b = 1
. ⇒ a = 2 và b = 1
Công thức của hợp chất ion là: X2Y.
