Trắc nghiệm Bài 3: Cấu trúc lớp vỏ electron nguyên tử có đáp án
Bài 3: Cấu trúc lớp vỏ electron nguyên tử có đáp án
-
153 lượt thi
-
15 câu hỏi
-
0 phút
Danh sách câu hỏi
Câu 1:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Trong nguyên tử, electron chuyển động rất nhanh và không theo quỹ đạo xác định.
Câu 2:
Dựa trên sự khác nhau về hình dạng và định hướng của orbital trong nguyên tử, orbital được chia thành mấy loại?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Dựa trên sự khác nhau về hình dạng và định hướng của orbital trong nguyên tử, orbital được chia thành 4 loại: orbital s, orbital p, orbital d và orbital f.
Câu 3:
Orbital p có dạng hình gì?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Các orbital s có dạng hình cầu và orbital p có dạng hình số 8 nổi.
Câu 4:
Nếu orbital có 2 electron thì được biểu diễn như thế nào trong ô orbital?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Trong 1 orbital chỉ chứa tối đa 2 electron có chiều tự quay ngược nhau (nguyên lí loại trừ Pauli). Nếu orbital có 1 electron thì biểu diễn bằng 1 mũi tên đi lên, nếu orbital có 2 electron thì được biểu diễn bằng 2 mũi tên ngược chiều nhau, mũi tên đi lên viết trước.
Câu 5:
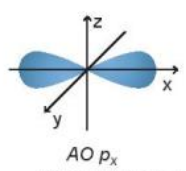
Orbital px có dạng hình số 8 nổi. Orbital này định hướng theo trục nào?
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Orbital px định hướng theo trục x như hình vẽ:
Câu 6:
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Số thứ tự lớp và tên gọi là các chữ cái in hoa như bảng sau:
|
n |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
Tên lớp |
K |
L |
M |
N |
O |
P |
Q |
Câu 7:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Phân lớp s chứa tối đa 2e
Phân lớp p chứa tối đa 6e
Phân lớp d chứa tối đa 10e
Phân lớp f chứa tối đa 14e
Câu 8:
Những electron ở lớp nào có năng lượng thấp hơn so với những electron ở các lớp khác?
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Trong nguyên tử, các electron sắp xếp thành từng lớp và phân lớp theo mức năng lượng từ thấp đến cao.
Những electron ở lớp K có năng lượng thấp hơn so với những electron ở các lớp khác vì những electron ở lớp K ở gần hạt nhân nên bị hút mạnh hơn về phía hạt nhân nên có năng lượng thấp hơn.
Câu 9:
Kí hiệu phân lớp nào sau đây là sai?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Lớp thứ hai chỉ có 2 phân lớp là 2s và 2p không có phân lớp 2d.
Lớp thứ ba có 3 phân lớp là 3s, 3p và 3d.
Lớp thứ tư có 4 phân lớp là 4s, 4p, 4d và 4f.
Câu 10:
Tổng số orbital trong lớp M là?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Trong lớp M (n = 3), tổng số orbital là: 32 = 9 AOCâu 11:
Tổng số electron tối đa trong lớp M là?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Lớp M có 3 phân lớp là 3s, 3p và 3d, trong đó phân lớp s chứa tối đa 2e, phân lớp p chứa tối đa 6e, phân lớp d chứa tối đa 10e.
Tổng số electron tối đa trong lớp M là: 2 + 6 + 10 = 18.
Câu 12:
Cấu hình electron của chlorine (Z = 17) là?
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Cấu hình electron của chlorine (Z = 17) là 1s22s22p63s23p5.
1s22s22p63s23p2 là cấu hình electron của silicon.
1s22s22p63s23p3 là cấu hình electron của phosphorus.
1s22s22p63s23p4 là cấu hình electron của sulfur.
Câu 13:
Cho nguyên tử X có cấu hình electron: [Ar]4s2. X là nguyên tố nào?
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Electron cuối cùng điền vào phân lớp s nên X là nguyên tố s.
Câu 14:
Cấu hình electron của nguyên tử nguyên tố X là 1s22s22p63s23p4. Số hiệu nguyên tử của X là?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Số hiệu nguyên tử của X là: Z = 2 + 2 + 6 + 2 + 4 = 16.
Câu 15:
Cho cấu hình electron của các nguyên tử sau đây:
M: 1s22s1
N: 1s22s22p5
P: 1s22s22p63s2
Q: 1s22s22p6
Có bao nhiêu nguyên tử của nguyên tố kim loại?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Cấu hình electron của nguyên tử M và P là kim loại vì M có 1 electron và P có 2 electron ở lớp ngoài cùng.
