Đề kiểm tra giữa học kì 1 Hóa học 10 có đáp án- Đề 1
-
153 lượt thi
-
33 câu hỏi
-
0 phút
Danh sách câu hỏi
Câu 1:
Nội dung thuộc đối tượng nghiên cứu của hóa học là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Đối tượng nghiên cứu của hóa học là chất và sự biến đổi của chất.
Do đó sự chuyển hóa thức ăn trong hệ tiêu hóa thuộc đối tượng nghiên cứu của hóa học.
Câu 2:
Tính chất (vật lí và hóa học) của chất được quyết định bởi yếu tố nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Cấu tạo quyết định đến tính chất (vật lý và hóa học) của chất.
Câu 3:
Quá trình nào sau đây thể hiện tính chất hóa học?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Đun nóng đường sucrose đến khi xuất hiện màu đen, đã có chất mới (than) tạo thành. Do đó quá trình này thể hiện tính chất hóa học.
Câu 4:
Loại liên kết trong phân tử oxygen là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Liên kết trong phân tử oxygen là liên kết cộng hóa trị.
Câu 5:
Các hạt cấu tạo nên hạt nhân của hầu hết nguyên tử là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Hạt nhân của hầu hết các nguyên tử gồm: proton và neutron (trừ H không có neutron).
Câu 6:
Phát biểu nào sau đây không đúng?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Phát biểu B không đúng vì nguyên tử có cấu tạo rỗng.
Câu 7:
Nguyên tử fluorine có 9 electron, hạt nhân nguyên tử này có điện tích là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Nguyên tử có Z proton, có điện tích hạt nhân là +Z.
Vậy fluorine có số proton = số electron = 9 nên có điện tích hạt nhân là +9.
Câu 8:
Trong nguyên tử, hạt không mang điện là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Hạt không mang điện trong nguyên tử là neutron.
Chú ý:
Hạt proton mang điện tích dương.
Hạt electron mang điện tích âm.
Câu 9:
Cho kí hiệu nguyên tử: . Điều khẳng định nào sau đây đúng?
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Dựa vào kí hiệu nguyên tử xác định được, Fe có:
- Số proton = số electron = số hiệu nguyên tử = 26 (vậy A đúng).
- Số khối: 56.
- Số neutron = A – Z = 56 – 26 = 30.
Câu 10:
Các đồng vị được phân biệt bởi yếu tố nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Đồng vị là các nguyên tử có cùng số proton nhưng khác nhau số neutron nên số khối của chúng là khác nhau.
Câu 11:
Trong tự nhiên copper (kí hiệu: Cu hay còn gọi là đồng) có hai đồng vị là chiếm 73% và . Nguyên tử khối trung bình của nguyên tố Cu là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Áp dụng công thức tính nguyên tử khối trung bình là có:
.
Câu 12:
Trong tự nhiên nguyên tố hydrogen có 3 đồng vị: . Hỏi có bao nhiêu loại phân tử H2 được tạo thành từ các loại đồng vị trên?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Viết lại phân tử H2 thành 2 nguyên tử H liên kết với nhau để tạo một phân tử H2.
Số cách chọn 2 nguyên tử H là: 6 cách
Câu 13:
Electron thuộc lớp nào sau đây liên kết chặt chẽ với hạt nhân nhất?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Lớp K gần hạt nhân nhất nên liên kết chặt chẽ với hạt nhân nhất.
Câu 14:
Lớp M có số electron tối đa là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Lớp M là lớp thứ 3.
Số electron tối đa ở lớp thứ 3 là: 2.32 = 18 (electron).
Câu 15:
Mỗi AO chứa tối đa bao nhiêu electron?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Mỗi AO chỉ chứa tối đa 2 electron.
Câu 16:
Xác suất tìm thấy electron trong toàn phần không gian bên ngoài đám mây electron là khoảng bao nhiêu phần trăm?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Xác suất tìm thấy electron trong đám mây electron khoảng 90% nên xác suất tìm thấy electron trong toàn phần không gian bên ngoài đám mây electron là khoảng 100% - 90% = 10%.
Câu 17:
Theo mô hình Rutherford – Bohr: Theo chiều từ hạt nhân ra ngoài lớp vỏ
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Theo mô hình Rutherford – Bohr: Theo chiều từ hạt nhân ra ngoài lớp vỏ, năng lượng của các electron tăng dần.
Câu 18:
Các phân lớp s, p, d và f lần lượt có các số AO tương ứng là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Các phân lớp s, p, d và f lần lượt có các số AO tương ứng là 1; 3; 5 và 7.
Câu 19:
Trong nguyên tử X, các electron được phân bố trên 3 lớp, lớp ngoài cùng có 3e. Vậy số đơn vị điện tích hạt nhân của X là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Cấu hình electron của X là: 1s22s22p63s23p1.
Vậy X có số đơn vị điện tích hạt nhân = số proton = số electron = 13.
Câu 20:
Ở trạng thái cơ bản, nguyên tử nitrogen (Z = 7) có số electron độc thân là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Cấu hình theo ô orbital của nitrogen là:
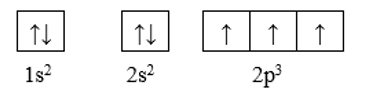
Như vậy, ở trạng thái cơ bản nguyên tử nitrogen có 3 electron độc thân.
Câu 21:
Một nguyên tử X có tổng số electron ở các phân lớp s là 6 và tổng số electron ở lớp ngoài cùng cũng là 6, cho biết X là nguyên tố hóa học nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Cấu hình electron nguyên tử X: 1s22s22p63s23p4.
Vậy số hiệu nguyên tử X = số proton = số electron = 16.
X là lưu huỳnh (sulfur, S).
Câu 22:
Cho nguyên tố A có số hiệu nguyên tử bằng 11. A là nguyên tố
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
A có số hiệu nguyên tử là 11 ⇒ A có 11 electron.
Cấu hình electron của A là: 1s2 2s2 2p6 3s1 ⇒ A có 1 electron lớp ngoài cùng.
Do đó, A là nguyên tố kim loại.
Câu 23:
Khẳng định nào sau đây là đúng?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Khẳng định đúng là:
Các electron thuộc cùng một lớp có năng lượng gần bằng nhau, thuộc cùng một phân lớp có năng lượng bằng nhau.
Câu 24:
Bảng tuần hoàn các nguyên tố hóa học hiện nay gồm
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Bảng tuần hoàn các nguyên tố hóa học hiện nay gồm: 118 nguyên tố hóa học, 7 chu kì, 18 cột (được chia thành 8 nhóm A; 8 nhóm B, mỗi nhóm tương ứng với một cột, riêng nhóm VIIIB có ba cột).
Câu 25:
Lớp electron thứ 4 có tên gọi là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Lớp electron thứ 4 hay còn gọi là lớp N.
Câu 26:
Nguyên tố X có số thứ tự ô là 20. Xác định chu kì, nhóm của X trong bảng tuần hoàn các nguyên tố hóa học?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Cấu hình electron nguyên tử X: 1s22s22p63s23p64s2 hay [Ar]4s2.
Vậy X ở chu kì 4 do có 4 lớp electron; nhóm IIA do 2 electron hóa trị, nguyên tố s.
Câu 27:
X có cấu hình e ở phân lớp ngoài cùng là 3d34s2. X thuộc
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
X thuộc chu kì 4 do có 4 lớp electron; nhóm VB do có 5 electron hóa trị, nguyên tố d.
Câu 28:
Số thứ tự của ô nguyên tố bằng
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Số thứ tự của ô nguyên tố bằng số hiệu nguyên tử của nguyên tố đó.
Câu 29:
 Xem đáp án
Xem đáp án
Gọi phần trăm số nguyên tử của đồng vị là x (%)
⇒ Phần trăm số nguyên tử của đồng vị là là (100 - x) %
Áp dụng công thức tính nguyên tử khối trung bình ta có:
Hạy trong tự nhiên đồng vị chiếm 93,5% tổng số nguyên tử.
Giả sử có 1 mol KCl thì tổng số mol các đồng vị của K là 1 mol, trong đó số mol của là mol
Vậy thành phần phần trăm về khối lượng của có trong KCl là
Câu 30:
 Xem đáp án
Xem đáp án
a) Cấu hình electron nguyên tử X là: 1s22s22p63s23p1.
⇒ X có 13 electron.
Theo bài ra: 2ZY – 2ZX = 8 ⇒ ZY = 17.
Cấu hình electron nguyên tử Y là: 1s22s22p63s23p5.
Câu 31:
 Xem đáp án
Xem đáp án
b)
+ Biểu diễn cấu hình electron của X theo ô orbital:
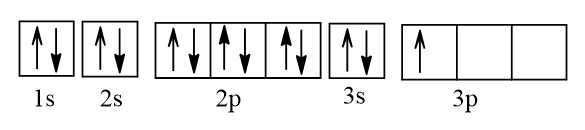
Vậy X có 1 electron độc thân.
+ Biểu diễn cấu hình electron của Y theo ô orbital:
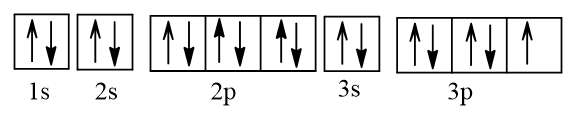
Vậy Y có 1 electron độc thân.
Câu 32:
Xác định vị trí của các nguyên tố dưới đây trong bảng tuần hoàn (có giải thích ngắn gọn):
(a) Nguyên tử của nguyên tố R có cấu hình electron lớp ngoài cùng là 3s23p4
 Xem đáp án
Xem đáp án
a) Cấu hình electron nguyên tử R: 1s22s22p63s23p4.
Vậy R thuộc:
+ Ô thứ 16 (do số hiệu nguyên tử = số electron = 16);
+ Chu kì 3 (do nguyên tử có 3 lớp electron);
+ Nhóm VIA (do có 6 electron hóa trị, nguyên tố p hoặc do lớp ngoài cùng có dạng ns2np4).
Câu 33:
(b) Nguyên tử của nguyên tố Y có 7 electron ở các phân lớp s.
 Xem đáp án
Xem đáp án
b) Cấu hình electron của Y: 1s22s22p63s23p64s1.
Vậy Y thuộc:
+ Ô thứ 19 (do số hiệu nguyên tử = số electron = 19);
+ Chu kì 4 (do nguyên tử có 4 lớp electron);
+ Nhóm IA (do có 1 electron hóa trị, nguyên tố s).
