Đề kiểm tra giữa học kì 1 Hóa học 10 có đáp án - Đề 1
-
304 lượt thi
-
32 câu hỏi
-
0 phút
Danh sách câu hỏi
Câu 1:
Nội dung nào dưới đây thuộc đối tượng nghiên cứu của hóa học?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Hóa học nghiên cứu về thành phần, cấu trúc, tính chất, sự biến đổi của các chất và các hiện tượng kèm theo.
Vậy nội dung thuộc đối tượng nghiên cứu của hóa học là: Cấu tạo của chất và sự biến đổi của chất.
Câu 2:
Trong thành phần nguyên tử, những hạt mang điện tích là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Trong nguyên tử:
- Hạt proton mang điện tích dương;
- Hạt electron mang điện tích âm;
- Hạt neutron không mang điện.
Câu 3:
Nguyên tử không mang điện vì
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Nguyên tử không mang điện (trung hòa về điện) vì có tổng số hạt proton (mang điện tích dương) bằng tổng số hạt electron (mang điện tích âm).
Câu 4:
Nếu đường kính của hạt nhân nguyên tử khoảng 10-2 pm thì đường kính của nguyên tử khoảng
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Kích thước của nguyên tử lớn hơn khoảng 10 000 lần kích thước của hạt nhân nguyên tử.
Nếu đường kính của hạt nhân nguyên tử khoảng 10-2 pm thì đường kính của nguyên tử khoảng 10-2.10 000 = 102 pm.
Câu 5:
Trong tự nhiên, argon có các đồng vị 40Ar, 38Ar, 36Ar chiếm tương ứng khoảng 99,604%, 0,063% và 0,333% số nguyên tử. Nguyên tử khối trung bình của Ar gần nhất với đáp án là
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Nguyên tử khối trung bình của argon là:
ˉAAr=40×99,604+38×0,063+36×0,33399,604+0,063+0,333≈39,99.
Câu 6:
Nguyên tử potassium (K) có 19 electron; 19 proton và 20 neutron. Số khối của nguyên tử potassium là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Nguyên tử potassium có số khối (A) = số proton + số neutron = 19 + 20 = 39.
Câu 7:
Dãy nào sau đây gồm các đồng vị của cùng một nguyên tố hóa học?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Dãy X2814, Y2914, Z3014 gồm các đồng vị của cùng một nguyên tố hóa học vì cùng có số hiệu nguyên tử (Z) = 14.
Câu 8:
Tất cả các nguyên tử có số đơn vị điện tích hạt nhân là 8 đều thuộc nguyên tố nào sau đây?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Tất cả nguyên tử có số đơn vị điện tích hạt nhân là 8 thuộc nguyên tố oxygen dù chúng có thể có số neutron khác nhau.
Câu 9:
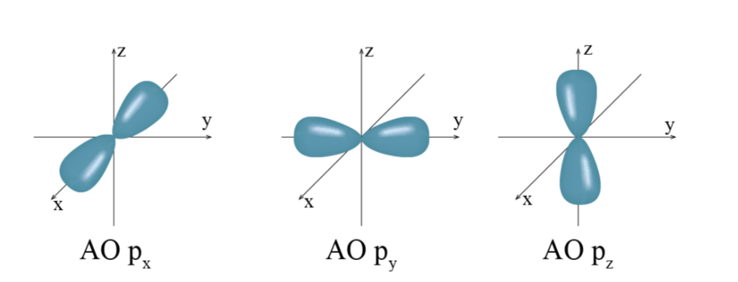
Orbital nguyên tử (kí hiệu là AO) là
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Orbital nguyên tử (kí hiệu là AO) là khu vực không gian xung quanh hạt nhân nguyên tử mà xác suất tìm thấy electron trong khu vực đó là lớn nhất (khoảng 90%).
Câu 10:
Mỗi orbital nguyên tử chứa tối đa bao nhiêu electron?
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Mỗi orbital nguyên tử chứa tối đa 2 electron có chiều tự quay ngược nhau (nguyên lí loại trừ Pauli).
Câu 11:
Lớp M có số phân lớp electron là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Phân lớp M (n = 3) có 3 phân lớp là 3s, 3p và 3d.
Câu 13:
Nguyên tử của nguyên tố neon (Z = 10) có cấu hình electron là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Neon có số electron bằng số hiệu nguyên tử = 10.
⇒ Cấu hình electron của nguyên tử neon là 1s22s22p6.
Câu 14:
Nguyên tử của nguyên tố potassium có 19 electron. Ở trạng thái cơ bản, potassium có số electron độc thân là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Cấu hình electron của potassium là 1s22s22p63s23p64s1 có thể được biểu diễn theo ô orbital như sau:
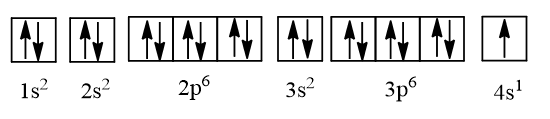
⇒ Ở trạng thái cơ bản potassium có 1 electron độc thân.
Câu 15:
Mendeleev sắp xếp các nguyên tố hóa học vào bảng tuần hoàn dựa theo quy luật về
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Mendeleev sắp xếp các nguyên tố hóa học vào bảng tuần hoàn dựa theo quy luật về khối lượng nguyên tử.
Câu 16:
Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp thành một hàng, gọi là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp thành một hàng, gọi là chu kì.
Câu 17:
Nguyên tố Mg thuộc chu kì 3 của bảng tuần hoàn. Nguyên tử nguyên tố Mg có số lớp electron là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Chú ý: Số lớp electron = số thứ tự chu kì
Nguyên tố Mg thuộc chu kì 3, có số lớp electron là 3.
Câu 18:
Bảng tuần hoàn hiện nay có bao nhiêu cột?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Bảng tuần hoàn hiện nay có 18 cột, chia thành 8 nhóm A (IA đến VIIIA) và 8 nhóm B (IB đến VIIIB), riêng nhóm VIIIB có 3 cột.
Câu 19:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Fluorine (F) là nguyên tố có độ âm điện lớn nhất trong bảng tuần hoàn nên có tính phi kim mạnh nhất.
Câu 20:
Xét ba nguyên tử nguyên tố có cấu hình electron lần lượt là
X: 1s22s22p63s1
Q: 1s22s22p63s2
Z: 1s22s22p63s23p1
Tính base tăng dần của các hydroxide là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Ta thấy các nguyên tố trên đều thuộc chu kì 3 trong bảng tuần hoàn.
Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính base của hydroxide tương ứng giảm dần.
⇒ Sắp xếp theo chiều tính base tăng dần: Z(OH)3 < Q(OH)2 < XOH.
Câu 21:
Phát biểu nào sau đây là sai?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Phát biểu C sai vì: Trong một nhóm, theo chiều tăng dần của điện tích hạt nhân, lực hút giữa hạt nhân với các electron lớp ngoài cùng giảm. Do đó, tính kim loại của các nguyên tố tăng dần, tính phi kim giảm dần.
Câu 22:
Trong các hydroxide dưới đây. Hydroxide lưỡng tính là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Al(OH)3 là hydroxide lưỡng tính
Al(OH)3 thể hiện tính acid khi tác dụng với base:
Al(OH)3 + NaOH ⟶ Na[Al(OH)4]
Al(OH)3 thể hiện tính base khi tác dụng với acid:
Al(OH)3 + 3HCl ⟶ AlCl3 + 3H2O.
Câu 23:
X là nguyên tố nhóm IIA. Công thức oxide ứng với hóa trị cao nhất của X là
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
X là nguyên tố nhóm IIA nên hóa trị của X trong oxide cao nhất là II. Công thức oxide ứng với hóa trị cao nhất của X là: XO.
Câu 24:
Nguyên tố X thuộc chu kì 3 nhóm VIIA. Công thức hóa học của hydroxide (ứng với hóa trị cao nhất) của X là
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Nguyên tố X thuộc chu kì 3, nhóm VIIA. Công thức hóa học của hydroxide (ứng với hóa trị cao nhất) của X là HXO4.
Câu 25:
Nguyên tử X có 15 electron ở lớp vỏ. Trong bảng tuần hoàn, nguyên tố X thuộc chu kì nào?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Cấu hình electron nguyên tử của X là 1s22s22p63s23p3
Dựa vào cấu hình electron nguyên tử ta thấy X có 3 lớp electron, vậy X thuộc chu kì 3.
Câu 26:
Yếu tố nào của nguyên tố hóa học cho dưới đây không biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử?
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Khối lượng nguyên tử không biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử.
Câu 27:
Nguyên tố Ca có số hiệu nguyên tử là 20. Phát biểu nào sau đây về Ca là không đúng?
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Nguyên tố Ca có số hiệu nguyên tử là 20
⇒ Số hiệu nguyên tử (Z) = số proton = số electron = 20.
Cấu hình electron nguyên tử: 1s22s22p63s23p64s2
⇒ Vỏ của nguyên tử Ca có 4 lớp electron và lớp ngoài cùng có 2 electron.
⇒ Nguyên tố Ca là một nguyên tố kim loại.
Câu 28:
Đại lượng đặc trưng cho khả năng hút electron của một nguyên tử khi tạo thành liên kết hóa học là
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Đại lượng đặc trưng cho khả năng hút electron của một nguyên tử khi tạo thành liên kết hóa học là độ âm điện.
Câu 29:
Nguyên tử X có tổng số các loại hạt bằng 52, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 16 hạt. Xác định thành phần các hạt cấu tạo nên nguyên tử X.
 Xem đáp án
Xem đáp án
Gọi P, N và E lần lượt là số proton, neutron và electron của X. Trong đó P = E.
Nguyên tử X có tổng số các loại hạt bằng 52 nên:
P + N + E = 52 hay 2P + N = 52 (1)
Trong nguyên tử X, số hạt mang điện nhiều hơn số hạt không mang điện là 16 hạt nên:
(P + E) – N = 16 hay 2P – N = 16 (2)
Từ (1) và (2) ta có hệ phương trình:
Vậy trong X có 17 proton; 17 electron và 18 neutron.
Câu 30:
Xác định vị trí (ô, chu kì và nhóm) của các nguyên tố sau (có giải thích ngắn gọn cách xác định):
a. Nguyên tố A có số hiệu nguyên tử là 20.
 Xem đáp án
Xem đáp án
a) Nguyên tố A (Z = 20), cấu hình electron: 1s22s22p63s23p64s2
Nguyên tố A thuộc ô 20 (do Z = 20); chu kì 4 (do có 4 lớp electron); nhóm IIA (do nguyên tố s, 2 electron hóa trị).
Câu 31:
b. Nguyên tố B có số đơn vị điện tích hạt nhân là 9.
 Xem đáp án
Xem đáp án
b) Nguyên tố B (Z = 9), cấu hình electron: 1s22s22p5
Nguyên tố B thuộc ô 9 (do Z = 9); chu kì 2 (do có 2 lớp electron); nhóm VIIA (do nguyên tố p, 7 electron hóa trị).
Câu 32:
Sắp xếp các nguyên tố sau: O (Z = 8), S (Z = 16), F (Z = 9) theo chiều tăng dần tính phi kim (có giải thích ngắn gọn).
 Xem đáp án
Xem đáp án
O (Z = 8): 1s22s22p4, suy ra O thuộc chu kì 2, nhóm VIA.
S (Z = 16): [Ne]3s23p4, suy ra S thuộc chu kì 3, nhóm VIA.
F (Z = 9): 1s22s22p5, suy ra F thuộc chu kì 2, nhóm VIIA.
Ta có:
O và F thuộc cùng một chu kì 2. Theo chiều điện tích hạt nhân tăng dần ta được tính phi kim F > O (1).
O và S thuộc cùng một nhóm VIA. Theo chiều điện tích hạt nhân tăng dần ta được tính phi kim O > S (2)
Từ (1) và (2) ⇒ Tính phi kim: S < O < F.