Chỉ từ 400k mua trọn bộ Giáo án Hóa học 11 Chân trời sáng tạo bản POWERPOINT trình bày đẹp mắt, thiết kế hiện đại (chỉ từ 30k cho 1 bài Giáo án lẻ bất kì):
B1: Gửi phí vào tài khoản0711000255837 - NGUYEN THANH TUYEN - Ngân hàng Vietcombank (QR)
B2: Nhắn tin tới zalo Vietjack Official - nhấn vào đây
Xem thử tài liệu tại đây: Link tài liệu
Giáo án PPT Hóa học 11 Bài 4: Ammonia và một số hợp chất ammonium







.............................................
..............................................
..............................................
Tài liệu có 24 trang, trên đây trình bày tóm tắt 10 trang của Giáo án PPT Hóa học 11 Chân trời sáng tạo Bài 4: Amonia và muối ammonium.
Giáo án Bài 4: Amonia và muối ammonium
I. MỤC TIÊU
1. Kiến thức
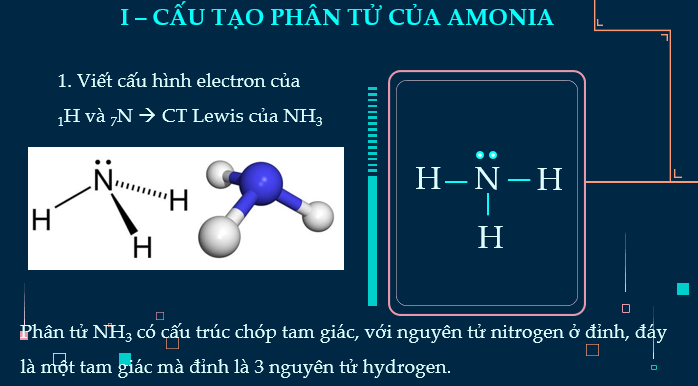
- Mô tả được công thức Lewis và hình học của phân tử ammonia.
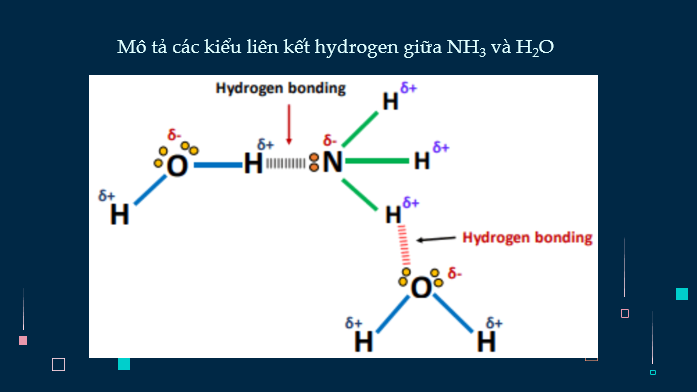
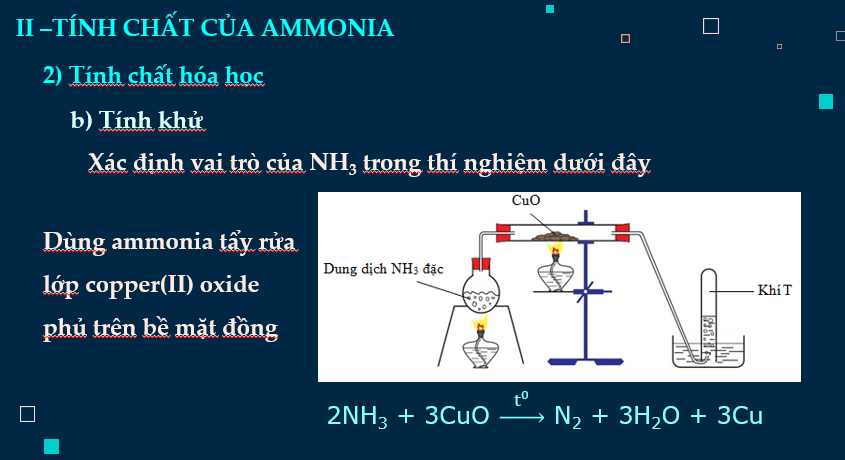
- Dựa vào đặc điểm cấu tạo của phân tử ammonia, giải thích được tính chất vật lí (tính tan), tính chất hóa học (tính base, tính khử). Viết được phương trình hóa học minh họa.
- Vận dụng được kiến thức về cân bằng hóa học, tốc độ phản ứng, enthalpy cho phản ứng tổng hợp ammonia từ nitrogen và hydrogen trong quá trình Haber.
- Trình bày được tính chất cơ bản của muối ammonium (dễ tan và phân li, chuyển hóa thành ammonia trong kiềm, dễ bị nhiệt phân) và nhận biết được ion ammonium trong dung dịch.
- Trình bày được ứng dụng của ammonia, ammonia nitrate và một số muối ammonium tan.
- Thực hiện được hoặc quan sát video thí nghiệm nhận biết được ion ammonium trong phân đạm chứa ammonium.
2. Năng lực
* Năng lực chung:
- Năng lực tự chủ và tự học: Kĩ năng tìm kiếm thông tin trong SGK, quan sát hình ảnh về mô hình nguyên tử để tìm hiểu về thành phần nguyên tử.
- Năng lực giao tiếp và hợp tác: Làm việc nhóm tìm hiểu về các hạt cấu tạo nên nguyên tử, thành phần của nguyên tử, khối lượng nguyên tử.
- Năng lực giải quyết vấn đề và sáng tạo: Giải thích được tại sao khối lượng nguyên tử được coi gần đúng là khối lượng của hạt nhân nguyên tử?
* Năng lực hóa học:
a. Nhận thức hoá học:
- Mô tả được công thức Lewis và hình học của phân tử ammonia.
- Dựa vào đặc điểm cấu tạo của phân tử ammonia, giải thích được tính chất vật lí (tính tan), tính chất hóa học (tính base, tính khử). Viết được phương trình hóa học minh họa.
- Vận dụng được kiến thức về cân bằng hóa học, tốc độ phản ứng, enthalpy cho phản ứng tổng hợp ammonia từ nitrogen và hydrogen trong quá trình Haber.
- Trình bày được tính chất cơ bản của muối ammonium (dễ tan và phân li, chuyển hóa thành ammonia trong kiềm, dễ bị nhiệt phân) và nhận biết được ion ammonium trong dung dịch.
- Trình bày được ứng dụng của ammonia, ammonia nitrate và một số muối ammonium tan.
- Thực hiện được hoặc quan sát video thí nghiệm nhận biết được ion ammonium trong phân đạm chứa ammonium.
b. Tìm hiểu tự nhiên dưới góc độ hóa học được thực hiện thông qua các hoạt động: Thảo luận, tìm tòi qua các video về quá trình Haber và tầm quan trọng trong sự phát triển nông nghiệp.
c. Vận dụng kiến thức, kĩ năng đã học tìm hiểu máy làm lạnh bằng ammonia.
3. Phẩm chất
- Chăm chỉ, tự tìm tòi thông tin trong SGK, qua internet về phân tử ammonia, quá trình tổng hợp ammonia, ứng dụng của ammonia, ammonia nitrate và một số muối ammonium tan.
- HS có trách nhiệm trong việc hoạt động nhóm, hoàn thành các nội dung được giao.
II. THIẾT BỊ DẠY HỌC VÀ HỌC LIỆU
- Hình ảnh, video về công thức Lewis và hình học của phân tử ammonia. Video minh họa tính chất vật lý, tính chất hóa học của ammonia, quá trình Haber. Hình ảnh và video về tính chất vật lí và tính chất hóa học của muối ammonium. Hình ảnh ứng dụng của ammonia và muối ammonium.
- Phiếu bài tập
III. TIẾN TRÌNH DẠY HỌC
Kiểm tra bài cũ: Không kiểm tra đầu giờ, kiểm tra kiến thức cũ lồng vào trong tiết học.
1. Hoạt động 1: Khởi động
a) Mục tiêu:
- Huy động các kiến thức đã được học của HS về kiến thức thực tế, số oxi hóa của nitrogen, màu chỉ thị theo môi trường, tạo nhu cầu tiếp tục tìm hiểu kiến thức mới.
- Tìm hiểu về lịch sử của NH3.
b) Nội dung:
- GV nêu câu hỏi, HS trả lời nhanh 4 câu hỏi để mở ra bức tranh hóa học về mô hình phân tử NH3
Câu 1: Trong nước tiểu thường có mùi gì?
Câu 2: Số oxi hóa thấp nhất của nguyên tố nitrogen?
Câu 3: Trong môi trường base thì phenophthalein có màu gì?
Câu 4: Sản phẩm nào được sinh ra từ phản ứng giữa N2 và H2?
- Từ câu trả lời của HS giáo viên giới thiệu lịch sử NH3.
c) Sản phẩm:
Câu 1: Trong nước tiểu thường có mùi khai.
Câu 2: Số oxi hóa thấp nhất của nguyên tố nitrogen là -3.
Câu 3: Trong môi trường base thì phenophthalein có màu hồng.
Câu 4: Sản phẩm nào được sinh ra từ phản ứng giữa N2 và H2 là NH3
- “Con đường hóa học” Người đầu tiên điều chế ra ammonia nguyên chất là nhà hóa học người Anh Josheph Priestley. Ông đã thực hiện thành công thí nghiệm của mình vào năm 1774. Tên gọi ammonia xuất phát từ những người tôn thờ thần Amun của Ai Cập – các Ammonians, bởi vì họ sử dụng amonium chloride (còn gọi là muối bay hơi) được tạo một cách tự nhiên trong các vết nứt gần núi lửa, và khi đun nóng nó phân hủy thành ammonia. Trong không khí có một lượng ammonia không đáng kể sinh ra do quá trình phân hủy của động vật, thực vật.
.....................................
.....................................
.....................................
Trên đây vừa trình bày tóm tắt 5 trang đầu của Giáo án PPT Hóa học 11 Bài 4: Ammonia và một số hợp chất ammonium sách Chân trời sáng tạo.
Xem thêm các bài giảng điện tử Hóa học 11 Chân trời sáng tạo, chi tiết khác:
Để mua Giáo án PPT Hóa học 11 Chân trời sáng tạo năm 2024 mới nhất, mời Thầy/Cô liên hệ Mua tài liệu hay, chọn lọc


