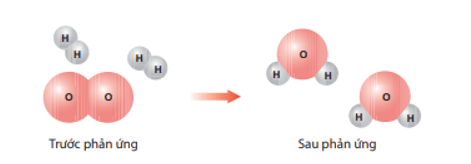
Giải bài tập KHTN lớp 8 Ôn tập chủ đề 1
a) Trong quá trình phản ứng, các liên kết trong phân tử các chất tham gia thay đổi như thế nào?
b) Phân tử nào được sinh ra sau phản ứng?
c) Nhận xét số lượng các nguyên tử trước và sau phản ứng.
Trả lời:
a) Trước phản ứng O liên kết với O; H liên kết với H. Sau phản ứng O liên kết với H.
b) Phân tử được sinh ra sau phản ứng là nước (H2O).
c) Số lượng các nguyên tử trước và sau phản ứng là không thay đổi.
Bài 2 trang 44 Khoa học tự nhiên 8: Một học sinh làm thí nghiệm như sau:
a) Hãy chỉ ra dấu hiệu để nhận biết có phản ứng xảy ra.
b) Xác định chất tham gia và sản phẩm tạo thành của thí nghiệm trên.
Trả lời:
a) Dấu hiệu để nhận biết có phản ứng xảy ra: sủi bọt khí trên bề mặt lớp vỏ trứng.
b) Chất tham gia: acetic acid; calcium carbonate (thành phần của vỏ trứng).
Sản phẩm tạo thành: calcium acetate, nước và khí carbon dioxide.
Bài 3 trang 44 Khoa học tự nhiên 8: Một bạn học sinh tiến hành thí nghiệm sau:
Trả lời:
Theo em điều này có phù hợp với định luật bảo toàn khối lượng.
Theo định luật bảo toàn khối lượng: mchất tham gia = mchất sản phẩm
Hay m đinh sắt + mdd trước = mđinh sắt + mdd sau + mkhí hydrogen
⇒ mđinh sắt + mdd sau = m đinh sắt + mdd trước - mkhí hydrogen
Hay (mđinh sắt + mdd sau) < (m đinh sắt + mdd trước).
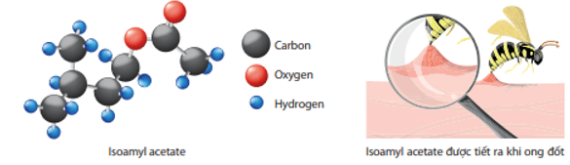
a) có bao nhiêu phân tử isoamyl acetate được giải phóng?
b) có bao nhiêu nguyên tử carbon?
Trả lời:
Số mol isoamyl acetate (C7H14O2) có trong 1 μg (bằng 1 × 10-6 gam) là:
nC7H14O2=1 × 10−6130≈7,69×10−9(mol).
Trong một vết ong đốt:
a) Số phân tử isoamyl acetate được giải phóng là:
7,69 × 10-9 × 6,022 × 1023 = 4,63 × 1015 (phân tử).
b) Số nguyên tử carbon là: 7 × 4,63 × 1015 = 3,241 × 1016 (nguyên tử).
a) Lập phương trình hoá học xảy ra của thí nghiệm trên.
b) Phản ứng trên có xảy ra hoàn toàn không? Tính hiệu suất phản ứng.
Trả lời:
a) Lập phương trình hoá học:
Bước 1: Viết sơ đồ của phản ứng:
KClO3 −−−MnO2→KCl + O2
Bước 2: Cân bằng số nguyên tử của mỗi nguyên tố:
+ Ta làm chẵn số nguyên tử O ở vế trái bằng cách thêm hệ số 2 trước KClO3:
2KClO3 −−−MnO2→KCl + O2
+ Để số nguyên tử O vế phải bằng với vế trái ta thêm hệ số 3 trước O2:
2KClO3 −−−MnO2→KCl + 3O2
+ Để số nguyên tử K và số nguyên tử Cl ở 2 vế bằng nhau ta thêm hệ số 2 trước KCl:
2KClO3 −−−MnO2→2KCl + 3O2
Bước 3: Phương trình hoá học hoàn chỉnh:
2KClO3 −−−MnO2→2KCl + 3O2
b) Phương trình hoá học: 2KClO3 −−−MnO2→2KCl + 3O2
Tỉ lệ các chất: 2 : 2 : 3
Số mol KClO3 đem nung là:
nKClO3=mKClO3MKClO3=4,9122,5=0,04(mol);
Theo tỉ lệ trong phương trình hoá học ta có:
nKCl lý thuyết = nKClO3=0,04(mol);
⇒ mKCl lý thuyết = 0,04 × 74,5 = 2,98 (gam).
Có khối lượng KCl lý thuyết lớn hơn khối lượng KCl thu được thực tế nên phản ứng xảy ra không hoàn toàn.
Hiệu suất của phản ứng là:
H(%)=2,52,98×100(%)=83,89(%).
a) Thay 2 gam hạt kẽm bằng 2 gam bột kẽm.
b) Thay dung dịch H2SO4 2,0 M bằng dung dịch H2SO4 1,0 M.
c) Thực hiện phản ứng ở 60 oC.
d) Dùng thể tích dung dịch H2SO4 2,0 M lên gấp đôi ban đầu.
Trả lời:
a) Thay 2 gam hạt kẽm bằng 2 gam bột kẽm tốc độ phản ứng tăng do tăng diện tích tiếp xúc giữa các chất tham gia.
b) Thay dung dịch H2SO4 2,0 M bằng dung dịch H2SO4 1,0 M tốc độ phản ứng giảm do giảm nồng độ của chất tham gia.
c) Thực hiện phản ứng ở 60 oC tốc độ phản ứng tăng do tăng nhiệt độ.
d) Dùng thể tích dung dịch H2SO4 2,0 M lên gấp đôi ban đầu tốc độ phản ứng không thay đổi.
Xem thêm lời giải SGK Khoa học tự nhiên lớp 8 Chân trời sáng tạo hay, chi tiết khác: