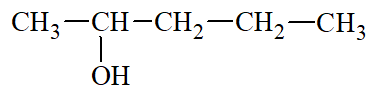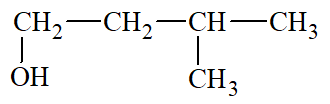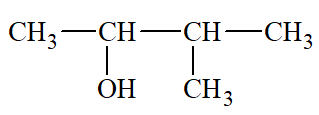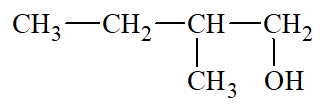Giải Hóa học 11 Bài 16: Alcohol
Lời giải:
- Alcohol là hợp chất hữu cơ có nhóm chức hydroxy (-OH) liên kết với nguyên tử carbon no.
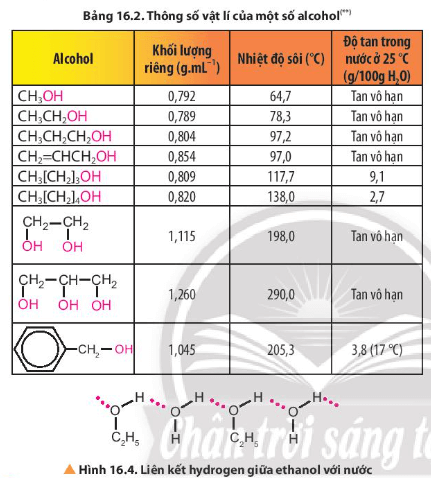
- Tính chất vật lí: Ở điều kiện thường, các alcohol tồn tại ở thể lỏng hoặc thể rắn; Giữa các phân tử alcohol có liên kết hydrogen nên có nhiệt độ sôi cao hơn hydrocarbon hoặc ether có phân tử khối tương đương; Do tạo được liên kết hydrogen với nước nên các alcohol có phân tử khối nhỏ tan tốt trong nước, độ tan giảm khi số nguyên tử carbon tăng …
- Tính chất hoá học: Alcohol có khả năng tham gia phản ứng thế nguyên tử hydrogen của nhóm – OH; phản ứng tạo thành ether; phản ứng tạo thành alkene; phản ứng oxi hoá. Ngoài ra các polyalcohol còn có tính chất đặc trưng riêng.
- Ứng dụng: Nhiều alcohol được ứng dụng rộng rãi trong các lĩnh vực đồ uống, dược phẩm, mĩ phẩm, y tế, phẩm nhuộm hoặc làm nhiên liệu …
1. Khái niệm và cấu trúc
Lời giải:
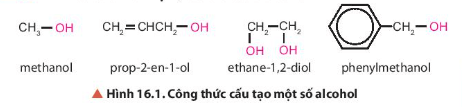
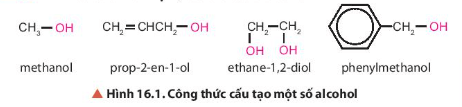
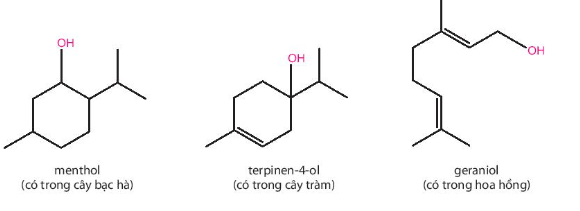
Trong các hợp chất trên đều có nhóm chức hydroxy (-OH).
Lời giải:
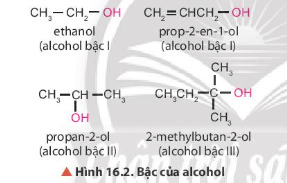
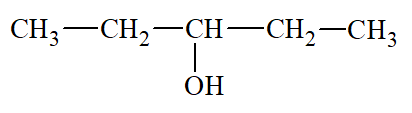
- Nguyên tử carbon liên kết với nhóm chức hydroxy là nguyên tử carbon no.
- Các xác định bậc của alcohol: Bậc alcohol là bậc của nguyên tử carbon liên kết với nhóm – OH.
Lời giải:
Phân tử methanol, ethanol chỉ chứa các liên kết đơn.
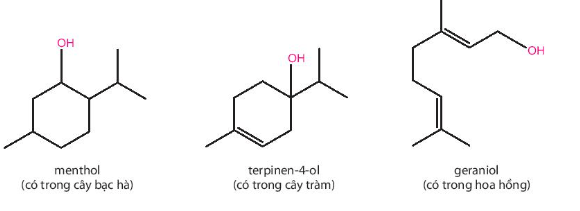
Lời giải:
- Menthol: alcohol bậc II.
- Terpinen – 4 – ol: alcohol bậc III.
- Geraniol: alcohol bậc I.
2. Đồng phân và danh pháp
Lời giải:
- Mạch carbon chính là mạch dài nhất, có chứa nhóm -OH.
- Đánh số thứ tự nguyên tử carbon mạch chính sao cho vị trí nguyên tử carbon liên kết với nhóm hydroxy là nhỏ nhất.
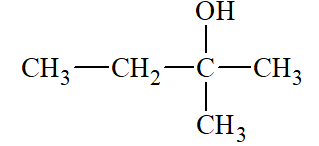
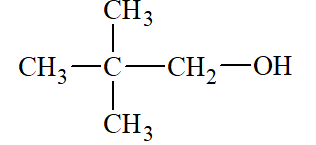
Lời giải:
|
STT |
Đồng phân |
Tên gọi |
|
1 |
CH3 – CH2 – CH2 – CH2 – CH2 – OH |
Pentan – 1 – ol |
|
2 |
|
Pentan – 2 – ol |
|
3 |
|
Pentan – 3 – ol |
|
4 |
|
3 – methylbutan – 1 – ol |
|
5 |
|
3 – methylbutan – 2 – ol |
|
6 |
|
2 – methylbutan – 2 – ol |
|
7 |
|
2 – methylbutan – 1 – ol |
|
8 |
|
2,2 – dimethylpropan – 1 – ol |
3. Tính chất vật lí
Lời giải:
Giữa các phân tử ethanol có liên kết hydrogen nên có nhiệt độ sôi cao hơn propane và dimethyl ether có phân tử khối tương đương.
Lời giải:
Do tạo được liên kết hydrogen với nước nên các alcohol có phân tử khối nhỏ tan tốt trong nước, độ tan giảm khi số nguyên tử carbon tăng.
Luyện tập trang 102 Hóa học 11: Tại sao ethanol được dùng làm dung môi cho nhiều loại nước hoa?
Lời giải:
Do hoà tan được nhiều chất nên ethanol được dùng làm dung môi cho nhiều loại nước hoa.
4. Tính chất hóa học
Lời giải:
Trong phân tử alcohol, nguyên tử oxygen có độ âm điện lớn hơn carbon và hydrogen nên liên kết C – O và liên kết O – H là các liên kết cộng hoá trị phân cực, trong đó nguyên tử oxygen mang một phần điện tích âm.
Lời giải:
Trong phản ứng với sodium liên kết O – H của phân tử alcohol bị phân cắt.
Luyện tập trang 103 Hóa học 11: Viết phương trình hoá học của phản ứng:
CH3CH2CH2OH + K →
Lời giải:
2CH3CH2CH2OH + 2K → 2CH3CH2CH2OK + H2.
Lời giải:
Có thể tạo thành 3 ether. Cụ thể: CH3OCH3; C2H5OC2H5 và CH3OC2H5.
Lời giải:
CH3 – CH2 – CH2 – OH →H2SO4,170° CH3 – CH = CH2 + H2O.
Câu hỏi thảo luận 9 trang 104 Hóa học 11: Tiến hành Thí nghiệm 1, quan sát hiện tượng.
Lời giải:
Hiện tượng: Ethanol cháy mạnh trong không khí và toả nhiều nhiệt.
Lời giải:
CH3 – CH2 – CH2 – OH + CuO CH3 – CH2 – CHO + Cu + H2O.
Lời giải:
Hiện tượng: Ống nghiệm (1): kết tủa tan dần, sau phản ứng thu được dung dịch có màu xanh đặc trưng; ống nghiệm (2): kết tủa không tan.
Phương trình hoá học của phản ứng xảy ra ở bước (2):
CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4.
Lời giải:
- Trích mẫu thử.
- Cho lần lượt từng mẫu thử tác dụng với Cu(OH)2:
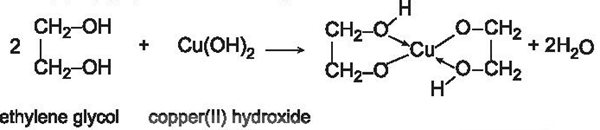
+ Không có hiện tượng xuất hiện → mẫu thử là methyl alcohol (CH3OH).
+ Cu(OH)2 tan dần tạo dung dịch màu xanh lam đậm → mẫu thử là ethylene glycol (C2H4(OH)2).
5. Ứng dụng và điều chế
Lời giải:
Nhiều alcohol được ứng dụng rộng rãi trong các lĩnh vực đồ uống, dược phẩm, mĩ phẩm, y tế, phẩm nhuộm hoặc làm nhiên liệu …
Lời giải:
- Mức tiêu thụ bia của Việt Nam dẫn đầu khu vực ASEAN. Theo báo cáo từ Vietnam-Briefing, mức tiêu thụ bia của Việt Nam tính đến năm 2022 chiếm 2,2% thị trường toàn cầu, ở mức 3,8 triệu lít bia hàng năm.
- Việc lạm dụng rượu bia dẫn đến nhiều hệ luỵ: mất an toàn khi tham gia giao thông, gia tăng tội phạm bạo lực, làm tổn thất kinh tế, gây ra các bệnh như suy gan, suy thận … Do đó, cần hạn chế sử dụng đồ uống có cồn, biết nói từ chối khi bị ép sử dụng rượu, bia; đã uống rượu, bia thì không nên tham gia giao thông…
Lời giải:
Dựa trên tính chất dễ cháy, khi cháy toả nhiều nhiệt mà methanol và ethanol được làm nhiên liệu thay thế cho động cơ đốt trong.
Câu hỏi thảo luận 13 trang 106 Hóa học 11: Có những phương pháp phổ biến nào để điều chế ethanol?
Lời giải:
Ethanol được điều chế bằng phản ứng hợp nước của ethylene hoặc lên men tinh bột. Cụ thể:
+ Ethanol được điều chế bằng phương pháp lên men các nguyên liệu chứa nhiều tinh bột hoặc đường như ngũ cốc (gạo, ngô, khoai, sắn …), quả chín (nho, anh đào…). Quá trình lên men này được tóm tắt như sau:
+ Ở nhiều nước có nền công nghiệp hoá chất phát triển, ethanol được điều chế bằng phản ứng hydrate hoá ethylene với xúc tác H2SO4 đặc hoặc H3PO4.
C2H4 + H2O C2H5OH
Lời giải:
Phương pháp trên dựa trên tính chất hoà tan nhiều chất của ethanol.
Bài tập (trang 107)
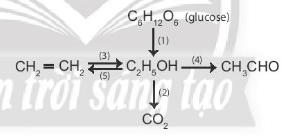
Bài 1 trang 107 Hóa học 11:Viết phương trình hoá học của các phản ứng xảy ra theo sơ đồ sau:
Lời giải:
Phương trình hoá học minh hoạ sơ đồ:
(1) C6H12O6 2C2H5OH + 2CO2
(2) C2H5OH + 3O2 2CO2 + 3H2O
(3) C2H4 + H2O C2H5OH
(4) C2H5OH + CuO CH3CHO + CuO + H2O
(5) CH3 – CH2 – OH CH2 = CH2 + H2O
Lời giải:
Ethanol sôi ở 78,3 oC, nước sôi ở 100 oC do đó không nên đun sôi quá mạnh để thu được rượu có nồng độ cao.
- Isopropyl alcohol 77,15% hoặc ethyl alcohol 83,33% có tác dụng khử trùng.
- Glycerol 1,45%, giữ ẩm da tay.
- Hydrogen peroxide 4,17% loại bỏ các bào tử vi khuẩn nhiễm trong dung dịch.
- Thành phần còn lại là nước cất hoặc nước sôi để nguội.
Mô tả cách thực hiện và pha chế 5 lít nước rửa tay khô từ các nguyên liệu trên (có thể thêm một ít hương liệu hoặc tinh dầu để giảm bớt mùi alcohol và tạo cảm giác dễ chịu).
Lời giải:
- Để pha 5 lít nước rửa tay khô từ ethyl alcohol cần chuẩn bị:
Vethyl alcohol =
Vglycerol =
Vhydrogen peroxide =
Nước cất, Tinh dầu.
Bình 5 lít, đũa khuẩy, phễu chiết, các bình xịt nhỏ hơn.
- Cách pha chế:
+ Đổ 4,17 lít ethyl alcohol 96o vào bình to;
+ Thêm tiếp 0,2085 lít hydrogen peroxide vào bình chứa ethyl alcohol;
+ Tiếp tục thêm 0,0725 lít (72,5 ml) glyxerol vào bình chứa ethyl alcohol;
+ Đổ nước cất vào bình chứa ethyl alcohol cho đến khi chạm vạch 5 lít.
+ Thêm khoảng 5 ml tinh dầu để giảm bớt mùi cồn và dung dịch có mùi thơm dễ chịu.
+ Đậy nắp bình sau khi pha xong để dung dịch không bị bay hơi.
+ Lắc nhẹ bình để các thành phần trộn lẫn vào nhau.
+ Cuối cùng chiết dung dịch qua các bình nhỏ hơn để tiện sử dụng và mang theo.
Xem thêm các bài giải SGK Hóa lớp 11 Chân trời sáng tạo hay, chi tiết khác: