Giải Hóa học 10 Bài 2: Nguyên tố hóa học
Lời giải:
- Các nguyên tử có cùng số đơn vị điện tích hạt nhân thì thuộc cùng một nguyên tố hóa học và có tính chất hóa học tương tự nhau.
- Số đơn vị điện tích hạt nhân = số proton = số electron.
I. Nguyên tố hóa học
Lời giải:
Các nguyên tử thuộc cùng một nguyên tử hóa học khi có cùng số đơn vị điện tích hạt nhân Z ⇒ Các nguyên tử L và E thuộc cùng một nguyên tố hóa học (đều có Z = 8).
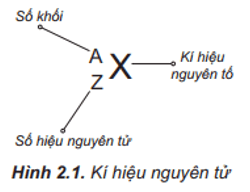
II. Kí hiệu nguyên tử
Câu hỏi 2 trang 18 Hóa học 10: Kí hiệu một nguyên tử cho biết những thông tin gì? Cho ví dụ.
Lời giải:
- Kí hiệu nguyên tử cho biết kí hiệu nguyên tố, số khối và số hiệu nguyên tử.
Thông qua kí hiệu nguyên tử xác định được thành phần các hạt có trong nguyên tử.
- Ví dụ: Kí hiệu nguyên tử F5626e cho biết:
+ Kí hiệu nguyên tố là Fe.
+ Số khối bằng 56.
+ Số hiệu nguyên tử (số đơn vị điện tích hạt nhân nguyên tử) là 26 nên trong hạt nhân nguyên tử sắt có 26 proton, vỏ nguyên tử sắt có 26 electron; số khối của nguyên tử Fe là 56 nên trong hạt nhân số neutron là 56 – 26 = 30.
Câu hỏi 3 trang 18 Hóa học 10: Hãy biểu diễn kí hiệu của một số nguyên tử sau:
a) Nitrogen (số proton = 7 và số neutron = 7).
b) Phosphorus (số proton = 15 và số neutron = 16).
c) Copper (số proton = 29 và số neutron = 34).
Lời giải:
a) Nitrogen
Số hiệu nguyên tử = số proton = 7
Số khối = số proton + số neutron = 7 + 7 = 14
⇒ Kí hiệu nguyên tử: N147
b) Phosphorus
Số hiệu nguyên tử = số proton = 15
Số khối = số proton + số neutron = 15 + 16 = 31
⇒ Kí hiệu nguyên tử: P3115
c) Copper
Số hiệu nguyên tử = số proton = 29
Số khối = số proton + số neutron = 29 + 34 = 63
⇒ Kí hiệu nguyên tử: C6329u
III. Đồng vị
a) S2814i,
b)
Lời giải:
Áp dụng:
Trong nguyên tử:
+ Số hiệu nguyên tử Z = số proton = số electron.
+ Số neutron = Số khối A – số hiệu nguyên tử Z.
a)
|
|
|||
|
Số proton |
14 | 14 | 14 |
|
Số electron |
14 | 14 | 14 |
|
Số neutron |
14 | 15 | 16 |
b)
|
|
||||
|
Số proton |
26 | 26 | 26 | 26 |
|
Số electron |
26 | 26 | 26 | 26 |
|
Số neutron |
28 | 30 | 31 | 32 |
IV. Nguyên tử khối
Lời giải:
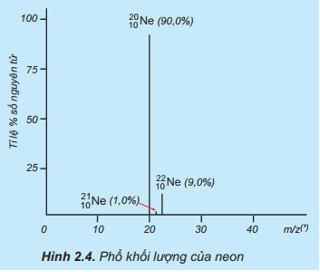
Nguyên tử khối trung bình của Ne là:
Lời giải:
Chromium có 4 nguyên tử đồng vị trong tự nhiên đó là 50Cr; 52Cr; 53Cr và 54Cr.
⇒ Nguyên tử khối trung bình của chromium không phải là số nguyên mà là 51,996.
Lời giải:
Gọi phần trăm số nguyên tử của đồng vị tồn tại trong tự nhiên là x %.
⇒ Phần trăm số nguyên tử của là 100 – x (%)
Ta có:
Lời giải:
Ví dụ: Trong tự nhiên, chlorine có hai đồng vị bền là (chiếm 75,77%) và (chiếm 24,23%).
Ta xác định được:
- Đồng vị và có nguyên tử khối lần lượt là 35 và 37.
- Nguyên tử trung bình của nguyên tố chlorine là
Lời giải:
- Nguyên tử khối của các nguyên tố hóa học không phải là các trị số nguyên vì các nguyên tố đều có ít nhất từ 2 đồng vị khác nhau và có số phần trăm số nguyên tử xác định.
- Đồng vị là những nguyên tử có cùng số đơn vị điện tích hạt nhân (cùng số proton) nhưng khác nhau số neutron. Nguyên tố hóa học là tập hợp các nguyên tử có cùng số đơn vị điện tích hạt nhân ⇒ Trong tự nhiên đã phát hiện được 94 nguyên tố.