Giải Hóa học 10 Bài 3: Nguyên tố hóa học
Mở đầu trang 16 Hóa học 10: Những nguyên tử nào dưới đây thuộc cùng một nguyên tố hóa học?
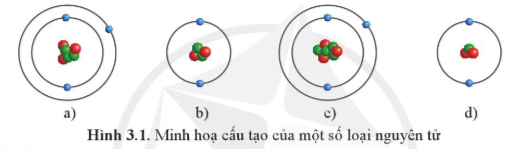
Trả lời:
Các nguyên tử mà hạt nhân có cùng số proton thuộc cùng một nguyên tố hóa học.
⇒ Nguyên tử ở hình a) và c) thuộc cùng một nguyên tố hóa học vì cùng có 3 proton (hạt màu đỏ) trong hạt nhân.
Nguyên tử ở hình b) và d) thuộc cùng một nguyên tố hóa học vì cùng có 2 proton (hạt màu đỏ) trong hạt nhân.
I. Nguyên tố hóa học
1. Khái niệm nguyên tố hóa học
Trả lời:
Khi hình thành muối lithium chloride (LiCl) nguyên tử Li cho đi 1 electron ở lớp ngoài cùng trở thành ion mang điện tích dương, kí hiệu là Li+.
Như vậy nguyên tử Li chỉ nhường electron ở lớp vỏ, số proton không thay đổi. Hay ion Li+ có 3 proton trong hạt nhân.
2. Số hiệu nguyên tử, số khối, kí hiệu nguyên tử
Trả lời:
Số hiệu nguyên tử = số proton = số electron = 1288=16.
Trả lời:
Khối lượng nguyên tử (gần đúng) ≈ khối lượng hạt nhân nguyên tử = Z + N (amu)
Số khối = Z + N
Ta thấy: Khối lượng nguyên tử xấp xỉ bằng số khối.
Trả lời:
Lithium có:
+ Số hiệu nguyên tử (Z) = số proton = 3.
+ Số khối (A) = 3 + 4 = 7.
Kí hiệu nguyên tử Li là L73i
Luyện tập 3 trang 17 Hóa học 10: Hoàn thành bảng sau:
|
Nguyên tử |
Số p |
Số n |
Kí hiệu nguyên tử |
|
C |
6 |
6 |
? |
|
? |
? |
? |
X2311 |
Trả lời:
Chú ý:
+ Số hiệu nguyên tử (Z) = số proton
+ Số neutron = số khối (A) – số proton.
|
Nguyên tử |
Số p |
Số n |
Kí hiệu nguyên tử |
|
C |
6 |
6 |
C126 |
|
Na |
11 |
12 |
X2311 |
II. Đồng vị, nguyên tử khối trung bình
1. Đồng vị
Trả lời:
Nguyên tử M115và T125 là đồng vị của nhau vì cùng có 5 proton trong hạt nhân nhưng khác nhau về số neutron (M có 6 neutron còn T có 7 neutron).
Trả lời:
Ta có: 1 ≤ NZ ≤ 1,25
⇔ Z ≤ N ≤ 1,25Z
⇔ Z + Z ≤ N + Z ≤ 1,25Z + Z
⇔ 8 + 8 ≤ A ≤ 1,25.8 + 8
⇔ 16 ≤ A ≤ 18
Vậy trong tự nhiên thường gặp các đồng vị: O168; O178; O188của oxygen.
Trả lời:
Trong tự nhiên oxygen có các đồng vị là O168; O178; O188. Trong đó đồng vị O168 chiếm nhiều nhất trong tự nhiên (khoảng 99,762%).
2. Nguyên tử khối trung bình
Trả lời:
Nguyên tử khối trung bình của argon là:
40×99,604+38×0,063+36×0,33399,604+0,063+0,333 ≈ 39,99
Trả lời:
Đặt phần trăm số nguyên tử của đồng vị C35l là x
Đặt phần trăm số nguyên tử của đồng vị C37l là y
Ta có: x + y = 100 (1)
Nguyên tử khối trung bình của chlorine là:
35×x+37×y100=35,45 (2)
Giải hệ (1) và (2) ta được: x = 77,5 và y = 22,5
Vậy phần trăm số nguyên tử của đồng vị C35l là 77,5%
Phần trăm số nguyên tử của đồng vị C37l là 22,5%
Bài tập (trang 20)
Bài 1 trang 20 Hóa học 10: Hoàn thành bảng sau đây:
|
Kí hiệu |
Số hiệu nguyên tử |
Số khối |
Số proton |
Số electron |
Số neutron |
|
A4018 r |
? |
? |
? |
? |
? |
|
? |
? |
39 |
19 |
? |
? |
|
? |
16 |
? |
? |
? |
20 |
Trả lời:
Chú ý:
+ Số hiệu nguyên tử (Z) = số proton = số electron.
+ Số neutron (N) = số khối (A) – số hiệu nguyên tử (Z)
+ Kí hiệu nguyên tử: XAZ
|
Kí hiệu |
Số hiệu nguyên tử |
Số khối |
Số proton |
Số electron |
Số neutron |
|
A4018 r |
18 |
40 |
18 |
18 |
22 |
|
K3919 |
19 |
39 |
19 |
19 |
20 |
|
S3616 |
16 |
36 |
16 |
16 |
20 |
Bài 2 trang 20 Hóa học 10: Phát biểu nào sau đây là đúng?
A. Những nguyên tử có cùng số electron thuộc cùng một nguyên tố hóa học.
B. Hai nguyên tử A và B đều có số khối là 14. Vậy hai nguyên tử này thuộc cùng một nguyên tố hóa học.
C. Những nguyên tử có cùng số neutron thì thuộc cùng một nguyên tố hóa học.
Trả lời:
Đáp án đúng là: A
A. Đúng. Những nguyên tử có cùng số proton thì thuộc cùng một nguyên tố hóa học.
Mà nguyên tử trung hòa về điện nên số proton = số electron
Trả lời:
Đặt phần trăm số nguyên tử của đồng vị C63u là x
Đặt phần trăm số nguyên tử của đồng vị C65u là y
Ta có: x + y = 100 (1)
63×x+65×y100=63,54 (2)
Giải hệ (1) và (2) ta được: x = 73 và y = 27
Vậy phần trăm số nguyên tử của đồng vị C63u là 73%
Phần trăm số nguyên tử của đồng vị C65u là 27%
Số mol tương ứng với 6,354 gam đồng là 6,35463,54 = 0,1 mol
Số mol đồng vị C63u trong 6,354 gam đồng là 73.0,1100 = 0,073 mol
Số mol đồng vị C65u trong 6,354 gam đồng là 27.0,1100 = 0,027 mol
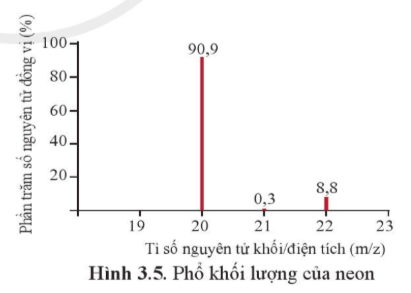
Trục tung biểu thị hàm lượng phần trăm về số nguyên tử của từng đồng vị, trục hoành biểu thị tỉ số của nguyên tử khối (m) của mỗi đồng vị với điện tích của các ion đồng vị tương ứng (điện tích z của các ion đồng vị neon đều bằng +1).
a) Neon có bao nhiêu đồng vị bền?
b) Tính nguyên tử khối trung bình của neon.
Trả lời:
a) Neon có 3 đồng vị bền: N20e (90,9%), N21e (0,3%), N22e (8,8%)
b) Nguyên tử khối trung bình của neon là
20×90,9+21×0,3+22×8,8100 = 20,179
Xem thêm lời giải bài tập sgk Hóa học 10 Cánh diều hay, chi tiết khác:
Bài 2: Thành phần của nguyên tử
Bài 4: Mô hình nguyên tử và orbital nguyên tử




