Đề cương Học kì 2 Hóa học 10 Chân trời sáng tạo
I. Kiến thức ôn tập
CHỦ ĐỀ 4: PHẢN ỨNG OXI HÓA - KHỬ VÀ ENTHALPY
1. Phản ứng oxi hóa - khử
- Số oxi hóa của một nguyên tử trong phân tử là điện tích của nguyên tử nguyên tố đó nếu giả định cặp electron chung thuộc hẳn về nguyên tử của nguyên tố có độ âm điện lớn hơn.
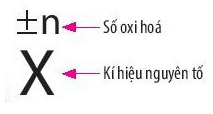
- Phản ứng oxi hoá - khử là phản ứng hoá học, trong đó có sự chuyển dịch electron giữa các chất phản ứng hay có sự thay đổi số oxi hoá của một số nguyên tử trong phân tử.
- Quá trình oxi hoá (sự oxi hoá) là quá trình nhường electron. Quá trình khử (sự khử) là quá trình nhận electron.
- Chất khử (chất bị oxi hóa) là chất nhường electron. Chất oxi hóa (chất bị khử) là chất nhận electron.
- Nguyên tắc của phương pháp: Tổng số electron chất khử nhường = Tổng số electron chất oxi hoá nhận.
+ Bước 1: Xác định số oxi hóa của các nguyên tố để tìm chất oxi hoá và chất khử.
+ Bước 2: Viết quá trình oxi hóa và quá trình khử, cân bằng mỗi quá trình.
+ Bước 3: Tìm hệ số thích hợp cho chất oxh và chất khử sao cho tổng số electron cho bằng tổng số electron nhận.
+ Bước 4: Đặt hệ số của các chất oxh và khử vào sơ đồ phản ứng, từ đó tính ra hệ số các chất khác. Kiểm tra cân bằng số nguyên tử của các nguyên tố và cân bằng điện tích hai vế để hoàn thành PTHH
- Ý nghĩa của phản ứng oxi hóa - khử
+ Một số phản ứng oxi hoá - khử quan trọng gắn liền với cuộc sống như sự cháy của than, củi; sự cháy của xăng dầu trong các động cơ đốt trong các quá trình điện phân; các phản ứng xảy ra trong pin, ắc quy, ...
+ Một số phản ứng oxi hoá - khử là cơ sở của quá trình sản xuất trong các ngành công nghiệp nặng, sản xuất các hoá chất cơ bản; sản xuất phân bón, thuốc bảo vệ thực vật; dược phẩm; ...
2. Enthalpy và biến thiên Enthalpy của phản ứng hóa học
- Phản ứng tỏa nhiệt, phản ứng thu nhiệt:
+ Phản ứng tỏa nhiệt là phản ứng hoá học trong đó có sự giải phóng nhiệt năng ra môi trường.
+ Phản ứng thu nhiệt là phản ứng hoá học trong đó có sự hấp thụ nhiệt năng từ môi trường.
- Biến thiên Enthalpy chuẩn của phản ứng
+ Biến thiên enthalpy chuẩn (hay nhiệt phản ứng chuẩn) của một phản ứng hoá học, được kí hiệu là là nhiệt kèm theo phản ứng đó trong điều kiện chuẩn.
+ Điều kiện chuẩn: áp suất 1 bar (đối với chất khí), nồng độ 1 mol/L (đối với chất tan trong dung dịch) và thường chọn nhiệt độ 25°C (hay 298 K).
- Enthalpy tạo thành (nhiệt tạo thành): Enthalpy tạo thành của một chất là nhiệt kèm theo phản ứng tạo thành 1 mol chất đó từ các đơn chất bền nhất.
- Ý nghĩa của dấu và giá trị
+ Phản ứng tỏa nhiệt:
+ Phản ứng thu nhiệt:
+ Thường các phản ứng có < 0 thì xảy ra thuận lợi.
- Tính biến thiên Enthalpy của phản ứng dựa vào năng lượng liên kếtt
- Phản ứng hóa học xảy ra khi có sự phá vỡ các liên kết hoá học của chất đầu (cđ) và hình thành các liên kết hoá học của sản phẩm (sp). Sự phá vỡ các liên kết cần cung cấp năng lượng, sự hình thành các liên kết lại giải phóng năng lượng.
aA (g) + bB (g) → mM (g) + nN (g)
= a x E b (A) + b x E b (B) – m x E b (M) - n x E b (N)
=> Tổng quát:
Với : tổng năng lượng liên kết trong phân tử chất đầu và sản phẩm của phản ứng.
Chú ý: Tính biến thiên enthalpy của phản ứng dựa vào năng lượng liên kết được áp dụng cho phản ứng trong đó các chất đều có liên kết cộng hoá trị ở thể khí khi biết giá trị năng lượng liên kết của tất cả các chất trong phản ứng.
- Tính biến thiên Enthalpy của phản ứng dựa vào Enthalpy
aA + bB → MM + nN
(2)
=> Tổng quát:
Với : tổng enthalpy tạo thành ở điều kiện chuẩn tương ứng của sản phẩm, chất đầu của phản ứng.
CHỦ ĐỀ: TỐC ĐỘ PHẢN ỨNG HÓA HỌC VÀ NGUYÊN TỐ NHÓM VIIA - HALOGEN
1. Tốc độ phản ứng hóa học
- Tốc độ phản ứng của phản ứng hoá học là đại lượng đặc trưng cho sự biến thiên nồng độ của một trong các chất phản ứng hoặc sản phẩm trong một đơn vị thời gian.
- Tốc độ phản ứng kí hiệu là v, có đơn vị: (đơn vị nồng độ)/ (đơn vị thời gian)
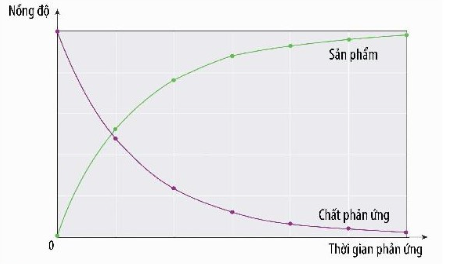
- Tốc độ trung bình của phản ứng là tốc độ được tính trong một khoảng thời gian phản ứng.
aA + bB → bC + dD
- Biểu thức tốc độ trung bình của phản ứng:
Trong đó:
: tốc độ trung bình của phản ứng
: sự biến thiên nồng độ
: biến thiên thời gian
C1, C2 là nồng độ của một chất tại 2 thời điểm tương ứng t1, t2
- Mối quan hệ giữa nồng độ và tốc độ tức thời của phản ứng hoá học được biểu diễn bằng biểu thức:
Trong đó:
+ k là hằng số tốc độ phản ứng
+ CA, CB là nồng độ (M) chất A, B tại thời điểm đang xét.
+ Khi nồng độ chất phản ứng bằng đơn vị (1 M) thì k = v, vậy k là tốc độ của phản ứng và được gọi là tốc độ riêng, đây là ý nghĩa của hằng số tốc độ phản ứng.
+ Hằng số k chỉ phụ thuộc vào bản chất của chất phản ứng và nhiệt độ.
- Các yếu tố ảnh hưởng đến tốc độ phản ứng:
+ Ảnh hưởng của nồng độ: Khi tăng nồng độ chất phản ứng, tốc độ phản ứng tăng.
+ Ảnh hưởng của nhiệt độ: Khi tăng nhiệt độ, tốc độ phản ứng tăng.
Mối quan hệ giữa nhiệt độ và tốc độ phản ứng hoá học được biểu diễn bằng công thức:
Trong đó: vt1, vt2 là tốc độ phản ứng ở 2 nhiệt độ t1 và t2; là hệ số nhiệt độ Van't Hoff.
Quy tắc Vant Hoff chỉ gần đúng trong khoảng nhiệt độ không cao.
+ Ảnh hưởng của áp suất: Đối với phản ứng có chất khí tham gia, tốc độ phản ứng tăng khi tăng áp suất.
+ Ảnh hưởng của bề mặt tiếp xúc: Khi tăng diện tích bề mặt tiếp xúc của chất phản ứng, tốc độ phản ứng tăng.
+ Ảnh hưởng của chất xúc tác: Chất xúc tác làm tăng tốc độ của phản ứng hoá học, nhưng vẫn được bảo toàn về lượng và chất khi kết thúc phản ứng.
2. Nguyên tố nhóm VIIA - Halogen
- Nhóm halogen gồm những nguyên tố thuộc nhóm VIIA trong bảng tuần hoàn các nguyên tố hóa học: fluorine (F); chlorine (Cl); bromine (Br); iodine (I); astatine (At) và tennessine (Ts).
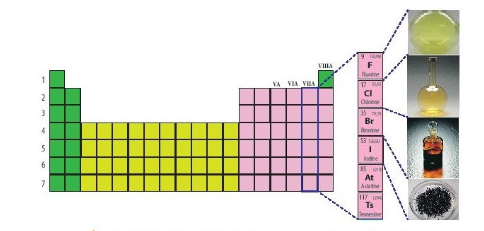
- Cấu hình electron, đặc điểm cấu tạo phân tử halogen
+ Nguyên tử các nguyên tố halogen đều có 7e lớp ngoài cùng (ns2np5)
+ Ở trạng thái tự do, 2 nguyên tử halogen góp chung 1e với nhau tạo 1 liên kết cộng hóa trị không cực. 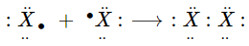
(X là kí hiệu chỉ các nguyên tố halogen)
⟶ Công thức cấu tạo: X−X
⟶ Công thức phân tử: X2
- Tính chất vật lý:
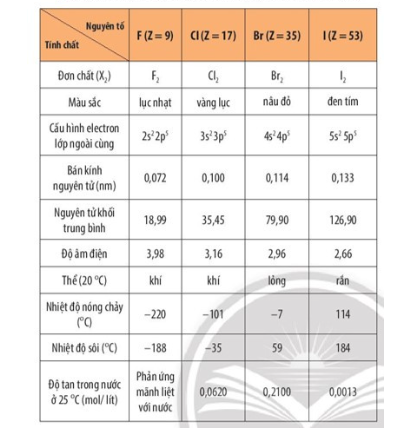
- Tính chất hóa học:
+ Halogen có cấu hình electron lớp ngoài cùng là ns2np5, nên nguyên tử có xu hướng nhận thêm 1 electron hoặc dùng chung electron với nguyên tử khác để đạt cấu hình electron bền vững của khí hiếm tương ứng.
Sơ đồ tổng quát: X + 1e → X-
+ Tính chất hóa học đặc trưng của halogen là tính oxi hóa mạnh, tính oxi hóa giảm dần từ fluorine đến iodine.
+ Tác dụng với kim loại
+ Tác dụng với hydrogen
+ Tác dụng với dung dịch muối halide
+ Tác dụng với dung dịch kiềm
- Hydrogen Halide và một số phản ứng của ion Halide
+ Tính chất vật lí của Hydrogen Halide
Nhiệt độ sôi của các hydrogen halide tăng dần từ HCl đến HI. Nguyên nhân là do khối lượng phân tử tăng, làm tăng năng lượng cần thiết cho quá trình sôi; đồng thời, sự tăng kích thước và số electron trong phân tử, dẫn đến tương tác van der Waals giữa các phân tử tăng.
Các phân tử hydrogen fluoride hình thành liên kết hydrogen liên phân tử, loại liên kết này bền hơn tương tác van der Waals, nên nhiệt độ sôi của hydrogen fluoride cao bất thường so với các hydrogen halide còn lại.
+ Hydrohalic Acid: Tính acid của các hydrohalic acid tăng dần từ hydrofluoric acid đến hydroiodic acid.
+ Tính khử của các ion Halide: Tính khử của các ion halide tăng theo chiều F- < Cl- < Br- < I-
+ Nhận biết ion Halide trong dung dịch: Phân biệt các ion F-, Cl-, Br- và I- bằng cách cho dung dịch silver nitrate (AgNO3) vào dung dịch muối của chúng.
II. Ma trận đề thi
Ma trận đề kiểm tra cuối kì 2 - Hóa học 10 – Chân trời sáng tạo
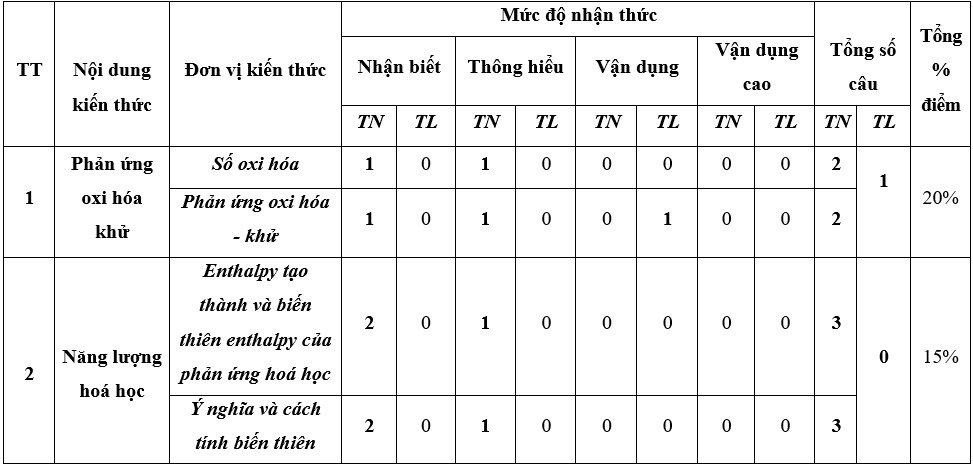
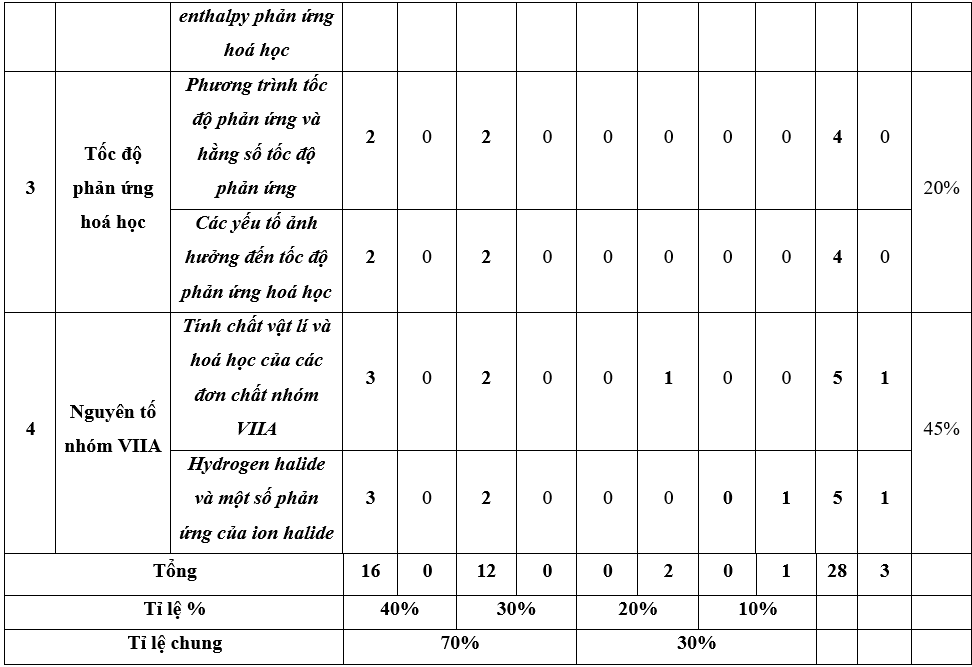
III. Câu hỏi ôn tập
Câu 1. Liên kết hydrogen là
A. liên kết được hình thành bởi lực hút tĩnh điện giữa các ion trái dấu.
B. liên kết được hình thành bởi một hay nhiều cặp electron chung giữa hai nguyên tử.
C. liên kết mà cặp electron chung được đóng góp từ một nguyên tử.
D. liên kết yếu được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn) với một nguyên tử khác (có độ âm điện lớn) còn cặp electron riêng.
Câu 2. Liên kết hydrogen không được hình thành giữa hai phân tử nào sau đây?
A. 2 phân tử H₂O.
B. 2 phân tử HF.
C. 1 phân tử H₂O và 1 phân tử CH4.
D. 1 phân tử H₂O và 1 phân tử NH3.
Câu 3. Nhiệt độ nóng chảy và nhiệt độ sôi của chất phụ thuộc chính vào yếu tố nào?
A. Hai yếu tố: khối lượng phân tử và liên kết giữa các phân tử.
B. Hai yếu tố: số lượng nguyên tử trong phân tử và liên kết giữa các phân tử.
C, Chỉ phụ thuộc vào khối lượng phân tử.
D. Chỉ phụ thuộc vào liên kết giữa các phân tử.
D. Câu 4. Liên kết hydrogen và tương tác van der Waals làm
A. tăng nhiệt độ nóng chảy và nhiệt độ sôi của các chất.
B. giảm nhiệt độ nóng chảy và nhiệt độ sôi của các chất.
C. tăng nhiệt độ nóng chảy và giảm nhiệt độ sôi của các chất.
D. giảm nhiệt độ nóng chảy và tăng nhiệt độ sôi của các chất.
Câu 5. Một loại liên kết rất yếu, hình thành do lực hút tĩnh điện giữa các cực trái dấu của phân tử, gọi là
A. liên kết cộng hóa trị.
B. liên kết ion.
C. tương tác van der Waals.
D. liên kết cho – nhận.
Câu 6. Mức độ ảnh hưởng của tương tác van der Waals so với liên kết hydrogen
A. Yếu hơn
B. Mạnh hơn
C. Cân bằng
D. Không so sánh được
Câu 7. Tương tác van der Waals làm
A. giảm nhiệt độ nóng chảy và nhiệt độ sôi của các chất
B. giảm nhiệt độ nóng chảy và tăng nhiệt độ sôi của các chất
C. tăng nhiệt độ nóng chảy và giảm nhiệt độ sôi của các chất
D. tăng nhiệt độ nóng chảy và nhiệt độ sôi của các chất
Câu 8. H₂O có nhiệt độ sôi cao hơn H2S là vì
A. H₂O có kích thước phân tử nhỏ hơn H2S
B. H₂O có khối lượng phân tử nhỏ hơn H2S
C. Giữa các phân tử H₂O có liên kết hydrogen
D. H₂O có khối lượng phân tử lớn hơn H2S
Câu 9. Tương tác van der Waals tăng khi
A. khối lượng phân tử tăng, kích thước phân tử tăng
B. khối lượng phân tử giảm, kích thước phân tử giảm
C. khối lượng phân tử tăng, kích thước phân tử giảm
D. khối lượng phân tử giảm, kích thước phân tử tăng
Câu 10. Chất nào sau đây không thể tạo được liên kết hydrogen?
A. H₂O
B. CH4
C. CH3OH
D. NH3
Câu 11. Cho các chất sau. CH4, H₂O, HF, BF3, C2H5OH, PCl5. Số chất tạo được liên kết hydrogen là
A. 2
B. 3
C. 4
D. 5
Câu 13. Giữa H₂O và C2H5OH có thể tạo ra bao nhiêu kiểu liên kết hydrogen?
A. 1
B. 2
C. 3
D. 4
Câu 14. Điền vào chỗ trống:
Số oxi hóa của một nguyên tử trong phân tử là ……(1)….của nguyên tử nguyên tố đó nếu giả định cặp electron chung thuộc hẳn về nguyên tử của nguyên tố có ……(2)…….lớn hơn.
A. (1) điện tích, (2) độ âm điện.
B. (1) độ âm điện, (2) điện tích.
C. (1) electron, (2) độ âm điện.
D. (1) độ âm điện, (2) electron.
Câu 15. Chất khử là chất:
A. Cho điện tử (electron), chứa nguyên tố có số oxi hóa tăng sau phản ứng.
B. Cho điện tử, chứa nguyên tố có số oxi hóa giảm sau phản ứng.
C/ Nhận điện tử, chứa nguyên tố có số oxi hóa tăng sau phản ứng.
D. Nhận điện tử, chứa nguyên tố có số oxi hóa giảm sau phản ứng.
Xem thêm các câu hỏi ôn tập khác trong file đính kèm bên dưới
IV. Đề thi minh họa
Đề số 1
Phần I: Trắc nghiệm (7 điểm)
Câu 1: Số oxi hoá của sulfur trong hợp chất H2SO3 là
A. +2. B. +4.
C. +6. D. +8.
Câu 2: Cho các hợp chất sau: N2, N2O, NH3, HNO3, (NH4)2CO3. Số trường hợp trong đó nitrogen có số oxi hoá -3 là
A. 4. B. 3.
C. 2. D. 1.
Câu 3: Cho các phản ứng hoá học sau:
(a) 2HCl + Fe → FeCl2 + H2.
(b) 4HCl + MnO2 → MnCl2 + Cl2 + 2H2O.
(c) HCl + KOH → KCl + H2O.
(d) 2HCl + Na2CO3 → 2NaCl + CO2 + H2O.
Số phản ứng trong đó HCl thể hiện tính khử là
A. 1. B. 2.
C. 3. D. 4.
Câu 4: Nguyên tử nitrogen chỉ thể hiện tính oxi hoá (trong điều kiện phản ứng phù hợp) trong hợp chất nào sau đây?
A. N2. B. NH3.
C. NO. D. NaNO3.
Câu 5: Cho phương trình nhiệt hóa học của phản ứng:
C(s) + H2O(g) →t° CO(g) + H2(g)
Phản ứng trên là phản ứng
A. thu nhiệt.
B. không có sự thay đổi năng lượng.
C. tỏa nhiệt.
D. có sự giải phóng nhiệt lượng ra môi trường.
Câu 6: Dựa vào phương trình nhiệt hóa học của phản ứng sau:
Giá trị của phản ứng 2CO(g) + O2(g) → 2CO2(g) là
A. – 283 kJ.
B. + 283 kJ.
C. + 566 kJ.
D. – 566 kJ.
Câu 7: Phản ứng nảo sau đây là phản ứng tỏa nhiệt?
A. Phản ứng nhiệt phân thuốc tím (KMnO4).
B. Phản ứng nhiệt phân Fe(OH)3.
C. Phản ứng đốt cháy cồn (ethanol).
D. Phản ứng nung NH4Cl(s) tạo ra NH3(g) và HCl(g).
Câu 8: Phương trình hóa học nào dưới đây biểu thị enthalpy tạo thành chuẩn của CO(g)?
A. 2C(than chì) + O2(g) → 2CO(g).
B. C(than chì) + O(g) → CO(g).
C. C(than chì) + .
D. C(than chì) + CO2(g) → 2CO(g).
Câu 9: Cho phản ứng hóa học xảy ra ở điều kiện chuẩn sau:
2NO2(g) (đỏ nâu) → N2O4(g) (không màu)
Biết NO2 và N2O4 có tương ứng là 33,18 kJ/mol và 9,16 kJ/mol. Điều này chứng tỏ phản ứng
A. tỏa nhiệt, N2O4 bền vững hơn NO2.
B. thu nhiệt, N2O4 bền vững hơn NO2.
C. tỏa nhiệt, NO2 bền vững hơn N2O4.
D. thu nhiệt, NO2 bền vững hơn N2O4.
Câu 10: Cho phản ứng tổng hợp ammonia (NH3) như sau:
N2(g) + 3H2(g) → 2NH3(g)
Biết năng lượng liên kết (kJ/mol) của N≡N và H–H lần lượt là 946 và 436. Năng lượng liên kết của N–H trong ammonia là
A. 391 kJ/mol.
B. 361 kJ/mol.
C. 245 kJ/mol.
D. 490 kJ/mol.
Câu 11: Tốc độ phản ứng viết theo định luật tác dụng khối lượng là
A. tốc độ trung bình của phản ứng.
B. tốc độ tức thời của phản ứng.
C. tốc độ tính trung bình trong một khoảng thời gian phản ứng.
D. tốc độ tính theo chất sản phẩm phản ứng.
Câu 12: Đối với phản ứng: , phát biểu nào sau đây đúng?
A. Tốc độ tiêu hao chất B bằng 3/2 tốc độ tạo thành chất C.
B. Tốc độ tiêu hao chất B bằng 2/3 tốc độ tạo thành chất C.
C. Tốc độ tiêu hao chất B bằng 3 tốc độ tạo thành chất C.
D. Tốc độ tiêu hao chất B bằng 1/3 tốc độ tạo thành chất C.
Câu 13: Phản ứng của H2 và I2 là phản ứng đơn giản: H2(g) + I2(g) → 2HI(g). Theo định luật tác dụng khối lượng, tốc độ của phản ứng này được viết dưới dạng là
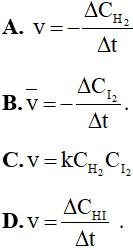
Câu 14: Tốc độ của một phản ứng hóa học lớn nhất khoảng thời điểm nào?
A. Bắt đầu phản ứng.
B. Khi phản ứng được một nửa lượng chất so với ban đầu.
C. Gần cuối phản ứng.
D. Không xác định được.
Câu 15: Yếu tố nào được sử dụng để tăng tốc độ phản ứng trong trường hợp sau: “Sự cháy diễn ra mạnh và nhanh hơn khi đưa lưu huỳnh (sulfur) đang cháy ngoài không khí vào lọ đựng khí oxygen”?
A. Nồng độ.
B. Áp suất.
C. Nhiệt độ.
D. A, B, C đều đúng.
Câu 16: Hệ số nhiệt độ Van’t Hoff được kí hiệu là
A. ∝. B. γ.
C. φ. D. θ.
Câu 17: Chất làm tăng tốc độ phản ứng mà sau phản ứng nó không bị thay đổi về lượng và chất được gọi là
A. chất ức chế.
B. chất xúc tác.
C. chất hoạt hóa.
D. chất điện li.
Câu 18: Cho ba mẫu đá vôi (không lẫn tạp chất) có cùng khối lượng: mẫu 1 dạng khối, mẫu 2 dạng viên nhỏ, mẫu 3 dạng bột mịn vào ba cốc đựng cùng thể tích dung dịch HCl (dư, cùng nồng độ, ở điều kiện thường). Thời gian để đá vôi tan hết trong ba cốc tương ứng là t1, t2, t3 giây. So sánh nào sau đây đúng?
A. t3 < t2 < t1.
B. t2 < t1 < t3.
C. t1 < t2 < t3.
D. t1 = t2 = t3.
Câu 19: Trong dãy các halogen, khi đi từ fluorine đến iodine thì
A. bán kính nguyên tử giảm dần.
B. độ âm điện giảm dần.
C. khả năng oxi hoá tăng dần.
D. năng lượng liên kết trong phân tử đơn chất tăng dần.
Câu 20: Trong các tính chất sau, những tính chất nào không phải là chung cho các đơn chất halogen?
A. Phân tử gồm 2 nguyên tử.
B. Có số oxi hoá -1 trong hợp chất với kim loại và hydrogen.
C. Có tính oxi hoá.
D. Tác dụng mạnh với nước.
Câu 21: Trong số các hydrohalic acid dưới đây, chất có tính khử mạnh nhất là
A. HF. B. HCl.
C. HBr. D. HI.
Câu 22: Dung dịch nào dưới đây không tác dụng với dung dịch AgNO3?
A. NaF. B. NaCl.
C. NaBr. D. Na2SO4.
Câu 23: Để chứng minh Cl2 vừa có tính khử vừa có tính oxi hóa, người ta cho Cl2 tác dụng với
A. dung dịch FeCl2.
B. dây sắt nóng đỏ.
C. dung dịch NaOH loãng.
D. dung dịch KI.
Câu 24: Cấu hình electron lớp ngoài cùng của các ion halide (X-) là
A. ns2np4.
B. ns2np5.
C. ns2np6.
D. (n – 1)d10ns2np5.
Câu 25: Phản ứng nào sau đây là sai?
A. 2F2 + 2H2O → 4HF + O2.
B. Cl2 + H2O ⇄ HCl + HClO.
C. Br2 + H2O ⇄ HBr + HBrO.
D. F2 + H2O ⇄ HF + HFO.
Câu 26: Hydrogen halide có nhiệt độ sôi cao nhất là
A. Hydrogen chloride.
B. Hydrogen fluoride.
C. Hydrogen bromide.
D. Hydrogen iodide.
Câu 27: Rót 3 mL dung dịch HCl 1 M vào 2 mL dung dịch NaOH 1 M, cho quỳ tím vào dung dịch sau phản ứng, mẩu quỳ tím sẽ:
A. hóa màu đỏ.
B. hóa màu xanh.
C. mất màu tím.
D. không đổi màu.
Câu 28: Cho các phát biểu sau:
(a) Trong các phản ứng hóa học, fluorine chỉ thể hiện tính khử.
(b) Hydrofluoric acid là acid yếu.
(c) Trong hợp chất, các halogen đều có số oxi hóa: -1, +1, +3, +5 và +7.
(d) Tính khử của các ion halogenua tăng dần theo thứ tự: F–, Cl–, Br–, I–.
Trong các phát biểu trên, số phát biểu sai là
A. 2. B. 4.
C. 3. D. 5.
Phần II: Tự luận (3 điểm)
Câu 1 (1 điểm): Để điều chế khí chlorine (Cl2) trong phòng thí nghiệm, người ta thường cho potassium permanganate (KMnO4) tác dụng với hydrogen chloride (HCl):
a) Lập phương trình hóa học của phản ứng hóa học trên bằng phương pháp thăng bằng electron, chỉ rõ chất khử, chất oxi hoá, quá trình oxi hoá, quá trình khử.
b) Giả sử lượng khí chlorine sinh ra phản ứng vừa đủ với dung dịch chứa 9,96 muối KX (X là một nguyên tố halogen) thu được 4,47 gam một muối duy nhất. Xác định công thức phân tử của muối KX.
Câu 2 (1 điểm): Hoàn thành các phương trình minh hoạ tính chất hoá học của các nguyên tố halogen:
a) Cl2 + Fe →
b) Cl2 + KOH
c) Br2 + KI →
d) I2 + Al
e) Ag + F2 →
Câu 3 (1 điểm): Cho 2,9825 gam hỗn hợp A gồm: NaX, NaY (X, Y là hai halogen liên tiếp, nguyên tử khối của X nhỏ hơn của Y) vào dung dịch AgNO3 dư. Kết thúc phản ứng thu được 0,7175 gam kết tủa. Xác định hai nguyên tố X, Y.
Hướng dẫn giải đề số 002
|
1 - B |
2 - C |
3 - A |
4 - D |
5 - A |
6 - D |
7 - C |
8 - C |
9 - A |
10 - A |
|
11 - B |
12 - A |
13 - C |
14 - D |
15 - A |
16 - B |
17 - B |
18 - C |
19 - B |
20 - D |
|
21 - D |
22 - A |
23 - C |
24 - C |
25 - D |
26 - B |
27 - A |
28 - A |
|
|
Câu 9:
= (N2O4) – 2. (NO2)
= 9,16 – 2.33,18 = -57,2 (kJ) < 0.
Phản ứng tỏa nhiệt, N2O4 bền hơn NO2.
Câu 10:
Ta có: = EN≡N + 3.EH–H – 6.EN–H
Þ
Phần II: Tự luận
Câu 1:
a)
Chất khử: HCl.
Chất oxi hoá: KMnO4.
Quá trình khử:
Quá trình oxi hoá:
Phương trình hoá học được cân bằng:
b)
Cl2 + 2KX → 2KCl + X2
Vậy MX = 166 – 39 =127 nên KX là KI.
Câu 2:
a) 3Cl2 + 2Fe → 2FeCl3.
b) 3Cl2 + 6KOH 5KCl + KClO3 + 3H2O.
c) Br2 + 2KI → 2KBr + I2.
d) 3I2 + 2Al 2AlI3.
e) 2Ag + F2 → 2AgF.
Câu 3:
Trường hợp 1: X là fluorine, Y là chlorine.
Phương trình hoá học:
NaCl + AgNO3 → NaNO3 + AgCl
Kết tủa là AgCl.
Þ nNaCl = n↓ = 0,005 mol Þ mNaCl = 0,005.58,5 = 0,2925 < mA.
Vậy trường hợp 1 thỏa mãn.
Trường hợp 2: Cả hai muối halogen đều tạo kết tủa
Đặt hai muối NaX và NaY tương ứng với 1 muối là (MNaX < < MNaY)
Phương trình hoá học:
Có nA = n↓ nên
Vậy trường hợp 2 không thỏa mãn.
Vậy hai halogen là fluorine và chlorine.
Xem thêm các đề cương, đề thi Hóa học 10 Chân trời sáng tạo hay, chi tiết khác:




