Công thức oxit cao nhất của các nguyên tố nhóm VIIA
I. Công thức oxit cao nhất của nhóm VIIA
Công thức oxide cao nhất của nhóm VIIA là: R2O7 (với R là nguyên tố nhóm VIIA; R khác fluorine, F).
Giải thích:
- Công thức oxide cao nhất của R có dạng:
+ R2On (với n thuộc nhóm A lẻ).
+ ROn/2 (với n thuộc nhóm A chẵn).
Do đó, công thức oxide cao nhất của các nguyên tố nhóm VIIA là: R2O7.
II. Mở rộng kiến thức
- Fluorine tạo với oxygen các hợp chất có dạng OnF2 (với n = 1, 2, 3, 4) nhưng không phải là oxide.
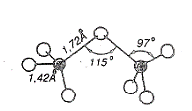
- Phân tử Cl2O7 có cấu tạo gồm 2 hình tứ diện có chung đỉnh. Tâm tứ diện là hai nguyên tử Cl, nguyên tử O là đỉnh chung của 2 tứ diện đó:
+ Ở điều kiện thường Cl2O7 là chất lỏng, không có màu, dạng dầu, hoá rắn ở -90oC và sôi ở 83oC. Bền nhất trong tất cả các oxide của chlorine nhưng không thật bền, đun nóng đến 120oC sẽ phân huỷ và gây nổ.
+ Cl2O7 là chất có tính oxi hoá nhưng tính oxi hoá kém nhất trong số các oxide của chlorine.
- Các oxide của bromine đều khó điều chế do rất không bền.
- Iodine tạo ra các oxide với oxygen như I2O4; I4O9; I2O5 nhưng quan trọng nhất là I2O5.
III. Bài tập vận dụng liên quan
Câu 1: R là nguyên tố nhóm VIIA. Trong công thức oxide cao nhất tương ứng R chiếm 58,82% về khối lượng. Oxide cao nhất của R là
A. F2O7.
B. N2O3.
C. Cl2O7.
D. Br2O7.
Hướng dẫn giải:
Đáp án D
Vì R thuộc nhóm VIIA ⇒ công thức oxide cao nhất của R là R2O7.
⇒MRMR2O7.100%=58,82%⇒2R(2R+112).100%=58,82%
⇒ R = 80 ⇒ R là Br.
Câu 2: X là nguyên tố nhóm VIIA. Công thức oxide cao nhất của X là
A. XO3.
B. X2O5.
C. XO2.
D. X2O7.
Hướng dẫn giải:
Đáp án D
X thuộc nhóm VIIA nên công thức oxide cao nhất sẽ là X2O7.
Câu 3: R là nguyên tố nhóm VIIA. Trong oxide cao nhất tương ứng O chiếm 61,20% về khối lượng. Oxide cao nhất của R là
A. Al2O3.
B. N2O5.
C. Br2O7.
D. Cl2O7.
Hướng dẫn giải:
Đáp án D
Vì R thuộc nhóm VIIA ⇒ công thức oxide cao nhất của R là R2O7
⇒MOMR2O7.100%=61,20%⇒112(2R+112).100%=61,20%
⇒ R = 35,5 ⇒ R là Cl.
Xem thêm Công thức oxit cao nhất hay, chi tiết khác: