Công thức Cấu tạo của HCl theo chương trình mới
1. Công thức cấu tạo của HCl
Từ công thức Lewis, ta loại bỏ đi các electron tự do (electron không tham gia liên kết) thu được công thức cấu tạo.
- Công thức cấu tạo của HCl là:
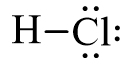
- Nhận xét
+ Hiệu độ âm điện: ∆χ = χ(Cl) – χ(H) = 3,16 – 2,2 = 0,96 > 0,4
+ Liên kết H – Cl là liên kết cộng hóa trị phân cực. Phân tử phân cực về phía nguyên tử Cl.
+ Liên kết H – Cl là liên kết đơn (liên kết σ).
+ Phân tử HCl có cấu tạo thẳng.
2. Bài tập mở rộng về HCl
Câu 1. Liên kết trong phân tử HCl được tạo thành do sự xen phủ của
A. 2 orbital s với nhau
B. 2 orbital s và 1 orbital p với nhau
C. 1 orbital s và 2 orbital với nhau
D. 1 orbital s và 1 orbital p với nhau
Hướng dẫn giải
Đáp án đúng là: D
Nguyên tử hydrogen (H) có cấu hình electron là 1s1
chlorine (Cl) có cấu hình electron là [Ne]3s23p5
⇒ Liên kết trong phân tử HCl được tạo thành do sự xen phủ 1 AO s của H và 1 AO p của Cl với nhau.
Câu 2. Công thức cấu tạo của phân tử HCl là
A. H - Cl
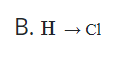
C. H = Cl
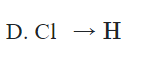
Hướng dẫn giải
Đáp án đúng là: A
Câu 3: Liên kết giữa H và Cl trong phân tử HCl là loại liên kết
A. ion
B. hydrogen
C. cộng hóa trị phân cực
D. cộng hóa trị không phân cực
Hướng dẫn giải
Đáp án đúng là: C
+ Hiệu độ âm điện: ∆χ = χ(Cl) – χ(H) = 3,16 – 2,2 = 0,96 > 0,4
⇒ Liên kết giữa H và Cl trong phân tử HCl là liên kết cộng hóa trị phân cực. Cặp electron chung lệch về phía nguyên tử Cl.
Xem thêm các bài viết về Công thức cấu tạo của các chất khác:




