Cho 0,765 gam hỗn hợp Al và Mg tan hoàn toàn trog 160 ml dung dịch H2SO4 0,25M, thu được dung dịch X và khí H2. Cho 340 ml dung dịch NaOH 0,25M vào X, sau khi phản ứng hoàn toàn thu được 1,65
Lời giải:
\[{n_{{H_2}S{O_4}}}\]= 0,25.0,16=0,04(mol)
Gọi nAl = a (mol); nMg = b (mol)
⇒ 27a + 24b = 0,765 (1)
\[\begin{array}{l}2Al + 3{H_2}S{O_4} \to A{l_2}{\left( {S{O_4}} \right)_3} + 3{\rm{ }}{H_2}\\a.........1,5a.............0,5a\end{array}\]
\[\begin{array}{l}Mg + {H_2}S{O_4} \to MgS{O_4} + {H_2}\\b.........b...............b\end{array}\]
\[ \Rightarrow {n_{{H_2}S{O_4}d{\rm{u}}}} = 0,04 - (1,5a + b)(mol)\]
Gọi \[{n_{Al{{(OH)}_3}}}\]bị hoà tan = c (mol)
nNaOH = 0,25.0,34 = 0,085 (mol)
2NaOH + H2SO4 → Na2SO4 + 2H2O
\[\begin{array}{l}2NaOH + MgS{O_4} \to Mg{\left( {OH} \right)_2} + N{a_2}S{O_4}\\2b..............b.................b\end{array}\]
\[\begin{array}{l}A{l_2}{(S{O_4})_3} + 6NaOH \to 2Al{(OH)_3} + 3N{a_2}S{O_4}\\0,5a................3a...............a\end{array}\]
\[\begin{array}{l}Al{(OH)_3} + NaOH \to NaAl{O_2} + 2{H_2}O\\c...................c\end{array}\]
Ta có:
\[{n_{NaOH}} = 2{n_{{H_2}S{O_4}}} + 2{n_{MgS{O_4}}} + 6{n_{A{l_2}{{(S{O_4})}_3}}} + {n_{Al{{(OH)}_3}}}\]bị hoà tan
→ (0,04 – 1,5 a – b).2 + 2b + 3a + c = 0,085 → c = 0,085 (2)
\[{n_{Mg{{(OH)}_2}}} = b(mol);{n_{Al{{(OH)}_3}}} = a - c(mol)\]
⇔ 58b + (a−c).78 = 1,65
⇔78a + 68b − 78c = 1,65 (3)
Từ (1) (2) và (3) suy ra a = 0,015; b = 0,015; c = 0,005
Vậy dung dịch X chứa :
Al2(SO4)3: 0,5a = 0,0075(mol)
MgSO4: b=0,015
H2SO4 dư: 0,04 − 1,5a − b = 0,0025 (mol)
Suy ra :
\[{n_{A{l^{3 + }}}}\]= 0,075.2 = 0,015 (mol)
\[{n_{M{g^{2 + }}}}\] = 0,015 (mol)
\[{n_{SO_4^{2 - }}}\]= 0,0075.3 + 0,015 + 0,0025 = 0,04
\[{n_{{H^ + }}}\] = 0,0025.2 = 0,005 (mol)
\[\begin{array}{l}B{a^{2 + }} + SO_4^{2 - } \to BaS{O_4}\\0,04....0,04......0,04\end{array}\]
⇒ \[{n_{Ba{{(OH)}_2}}} = {n_{B{a^{2 + }}}}\]= 0,04 (mol)
⇒ \[{V_{hh}} = \frac{{0,04}}{{0,1}} = 0,4\](lít)
nKOH = 0,4.0,8 = 0,32 (mol)
Suy ra:
\[{n_{O{H^ - }}}\] = 0,32 + 0,04.2 = 0,4(mol)
\[{H^ + } + O{H^ - } \to {H_2}O\]
\[M{g^{2 + }} + 2O{H^ - } \to Mg{(OH)_2}\]
\[A{l^{3 + }} + 3O{H^ - } \to Al{(OH)_3}\]
Số mol \[O{H^ - }\] phản ứng với \[A{l^{3 + }}\] là :
\[{n_{O{H^ - }}} = 0,4 - 0,005 - 0,015.2 = 0,365 > 4{n_{A{l^{3 + }}}} = 0,015.4 = 0,06\]
Vậy Al(OH)3 bị hòa tan kết
Suy ra kết tủa gồm: Mg(OH)2 0,015 mol; BaSO4: 0,04 mol
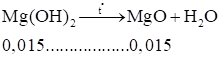
Vậy :
M = 0,015.40 + 0,04.233 = 9,92(gam).