Lý thuyết Hóa 11 Bài 6: Một số hợp chất của nitrogen với oxygen
A. Lý thuyết
I. Các oxide của nitrogen
1. Công thức, tên gọi
Oxide của nitrogen được kí hiệu chung là NOx, một loại hợp chất điển hình gây ô nhiễm không khí. Hợp chất NOx có trong không khí là N2O, NO, NO2, N2O4.
|
Oxide |
N2O |
NO |
NO2 |
N2O4 |
|
Tên gọi |
Dinitrogen oxide |
Nitrogen monoxide |
Nitrogen dioxide |
Dinitrogen tetroxide |
2. Nguồn gốc phát sinh NOx trong không khí
Bên cạnh nguồn gốc tự nhiên như núi lửa phun trào, cháy rừng, mưa dông kèm theo sấm sét, sự phân huỷ các hợp chất hữu cơ, thì sự phát sinh NOx chủ yếu là do hoạt động của con người. Các nguồn gây phát thải NOx nhân tạo từ hoạt động giao thông vận tải, sản xuất công nghiệp, nông nghiệp, nhà máy nhiệt điện và trong đời sống.
Một số nguyên nhân hình thành NOx trong không khí được thể hiện trong bảng sau:
|
Loại NOx |
NOx nhiệt (thermal – NOx) |
NOx nhiên liệu (fuel – NOx) |
NOx tức thời (prompt – NOx) |
|
Nguyên nhân tạo thành |
Nhiệt độ rất cao (trên 3 000 °C) hoặc tia lửa điện làm nitrogen trong không khí bị oxi hoá: N2 + O2 ⇌ 2NO |
Nitrogen trong nhiên liệu hoặc sinh khối kết hợp với oxygen trong không khí. |
Nitrogen trong không khí tác dụng với các gốc tự do (gốc hydrocarbon, gốc hydroxyl,...). |
NOx là một trong các nguyên nhân gây mưa acid, sương mù quang hoá, hiệu ứng nhà kính, thủng tầng ozone và hiện tượng phú dưỡng, làm ô nhiễm môi trường.
3. Mưa acid
- Nước mưa thông thường có pH khoảng 5,6 chủ yếu do có carbon dioxide hoà tan tạo môi trường acid yếu. Khi nước mưa có pH nhỏ hơn 5,6 thì gọi là hiện tượng mưa acid.
- Tác nhân chính gây mưa acid là SO2 và NOx, phát thải chủ yếu do các hoạt động công nghiệp, nhiệt điện, giao thông, khai thác và chế biến dầu mỏ…
Với sự xúc tác của các ion kim loại trong khói bụi, khi SO2 và NOx bị oxi hoá bởi oxygen, ozone, hydrogen peroxide, gốc tự do,... rồi hoà tan vào nước, tạo thành sulfuric acid và nitric acid. Ví dụ:
2SO2 + O2 + 2H2O xt→2H2SO4
4NO2 + O2 + 2H2O → 4HNO3
Các giọt acid li ti tạo thành theo mưa rơi xuống bề mặt Trái Đất.
- Mưa acid gây tác động xấu đối với môi trường, con người và sinh vật, rõ rệt nhất khi nước mưa có giá trị pH dưới 4,5. Mưa acid ảnh hưởng đến sinh vật, ăn mòn các công trình xây dựng, kiến trúc bằng đá và kim loại,...
II. Nitric acid
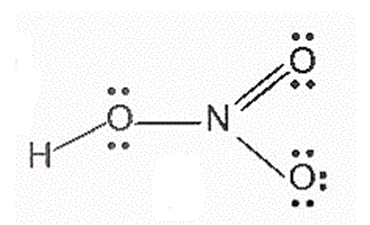
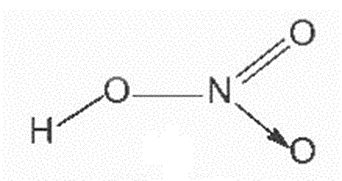
1. Cấu tạo
 |
 |
|
Công thức Lewis và công thức cấu tạo của nitric acid |
|
Đặc điểm cấu tạo của phân tử nitric acid:
- Nguyên tử nitrogen có số oxi hoá là +5, số oxi hoá cao nhất của nitrogen.
- Liên kết O – H phân cực mạnh về phía nguyên tử oxygen.
- Liên kết N → O là liên kết cho – nhận.
2. Tính chất vật lí
Nitric acid tinh khiết là chất lỏng, không màu, có khối lượng riêng D = 1,53 g/mL. Nitric acid nóng chảy ở −42 oC và sôi ở 83 oC. Nitric acid bốc khói mạnh trong không khí ẩm và tan vô hạn trong nước.
3. Tính chất hoá học
a) Tính acid
Nitric acid có khả năng cho proton, thể hiện tính chất của một acid Brønsted - Lowry. Trong công nghiệp, nitric acid được sử dụng để sản xuất phân bón giàu dinh dưỡng như ammonium nitrate, calcium nitrate.
NH3 + HNO3 → NH4NO3
CaCO3 + 2HNO3 → Ca(NO3)2 + CO2 + H2O
Ammonium nitrate cung cấp nguyên tố nitrogen ở cả dạng ammonium và cả dạng nitrate.
b) Tính oxi hoá
Phân tử nitric acid chứa nguyên tử nitrogen có số oxi hoá cao nhất (+5) nên nitric acid có khả năng nhận electron, thể hiện tính oxi hoá mạnh.
Do có tính oxi hoá mạnh, nitric acid thường được sử dụng để phá mẫu quặng trong việc nghiên cứu, xác định hàm lượng các kim loại trong quặng.
III. Hiện tượng phú dưỡng
- Nguyên nhân của hiện tượng phú dưỡng là do sự dư thừa dinh dưỡng đã cung cấp nguồn thức ăn dồi dào cho sinh vật phù du phát triển mạnh.
Thông thường, khi hàm lượng nitrogen trong nước (bao gồm ion nitrate, nitrite, ammonium) đạt 300 μg/L và hàm lượng phosphorus (các dạng ion phosphate) đạt 20 μg/L sẽ gây ra hiện tượng phú dưỡng.
- Nguồn dinh dưỡng ở ao, hồ thường có nguồn gốc từ nước thải (nông nghiệp, công nghiệp và sinh hoạt) được đưa đến ao, hồ thông qua các cống dẫn nước cố định hoặc do chảy tràn trên mặt đất khi mưa, lũ. Bên cạnh đó, ở nhiều đầm nuôi trồng thuỷ sản, sự dư thừa thức ăn chăn nuôi cũng tạo ra sự dư thừa dinh dưỡng.
- Hiện tượng phú dưỡng gây cản trở sự hấp thụ ánh sáng mặt trời vào nước, làm giảm sự quang hợp của thực vật thuỷ sinh. Rong, tảo phát triển mạnh gây thiếu nguồn oxygen trầm trọng cho các loài khác (đặc biệt là tôm, cá), gây mất cân bằng sinh thái. Ngoài ra, xác rong, tảo phân huỷ gây ô nhiễm môi trường nước, không khí và tạo chất bùn lắng xuống lòng ao, hồ.
Ao hồ có hiện tượng phú dưỡng do ô nhiễm
B. Bài tập
Đang cập nhật......
Xem thêm các bài tóm tắt lý thuyết Hóa 11 Kết nối tri thức hay, chi tiết khác:
Lý thuyết Bài 5: Ammonia. Muối ammonium
Lý thuyết Bài 7: Sulfur và sulfur dioxide



