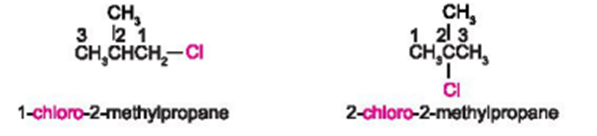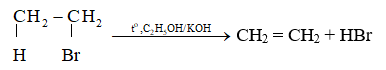Lý thuyết Hóa 11 Bài 19: Dẫn xuất halogen
A. Lý thuyết
I. Khái niệm, danh pháp
1. Khái niệm
Khi thay thế nguyên tử hydrogen trong phân tử hydrocarbon bằng nguyên tử halogen, được dẫn xuất halogen của hydrocarbon.
Công thức tổng quát của dẫn xuất halogen: RXn. Trong đó:
R: gốc hydrocarbon.
X: F, Cl, Br, I.
n: số nguyên tử halogen.
Ví dụ:
CH3Cl; CH3Br; CH2Cl2; CH2 = CH – Cl; C6H5Br…
2. Danh pháp
a) Danh pháp thay thế
Tên theo danh pháp thay thế của dẫn xuất halogen:
Vị trí của halogen + halogeno + tên hydrocarbon
Halogeno: Đuôi “-ine” trong tên halogen được đổi thành đuôi “-o”.
Chú ý:
+ Nếu halogen chỉ có một vị trí duy nhất thì không cần số chỉ vị trí halogen.
+ Mạch carbon được ưu tiên đánh số từ phía gần nhóm thế hơn (từ nguyên tử halogen hoặc từ nhánh alkyl).
+ Nếu có liên kết bội thì ưu tiên đánh số từ phía gần liên kết bội.
+ Nếu có nhiều nguyên tử halogen thì cần thêm độ bội (di, tri, tetra …) trước “halogeno”.
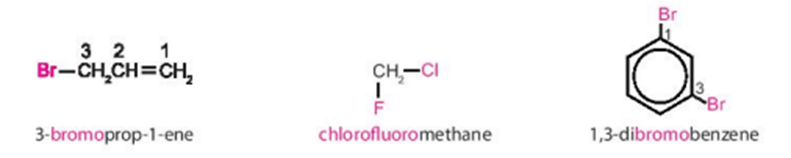
Ví dụ:
b) Tên thông thường
Một số dẫn xuất halogen thường gặp được gọi theo tên thông thường như chloroform (CHCl3); bromoform (CHBr3); iodoform (CHI3); CCl4 (carbon tetrachloride).
II. Đặc điểm cấu tạo
Trong phân tử dẫn xuất halogen, liên kết C – X phân cực về phía nguyên tử halogen, nguyên tử carbon mang một phần điện tích dương và nguyên tử halogen mang một phần điện tích âm. Vì vậy, liên kết C – X dễ bị phân cắt trong các phản ứng hoá học.
III. Tính chất vật lí
Phân tử của dẫn xuất halogen phân cực nên chúng có nhiệt độ nóng chảy và nhiệt độ sôi cao hơn các hydrocarbon có phân tử khối tương đương.
Ở điều kiện thường, một số chất có phân tử khối nhỏ (CH3Cl, CH3F,...) ở trạng thái khí. Các dẫn xuất có phân tử khối lớn hơn ở trạng thái lỏng hoặc rắn.
Các dẫn xuất halogen hầu như không tan trong nước, tan tốt trong các dung môi hữu cơ như hydrocarbon, ether....
IV. Tính chất hoá học
Liên kết C−X phân cực về phía nguyên tử halogen nên phản ứng đặc trưng của dẫn xuất halogen là phản ứng thế nguyên tử halogen. Ngoài ra, dẫn xuất halogen còn tham gia phản ứng tách HX.
1. Phản ứng thế nguyên tử halogen
Các dẫn xuất halogen có thể tham gia phản ứng với dung dịch kiềm, nguyên tử halogen bị thay thế bởi nhóm OH−, tạo thành alcohol.
Ví dụ:
CH3CH2Br + NaOH (loãng) CH3CH2OH + NaBr
Phương trình hóa học chung:
R – X + NaOH R – OH + NaX
(X: Cl, Br, I; X liên kết với nguyên tử carbon no).
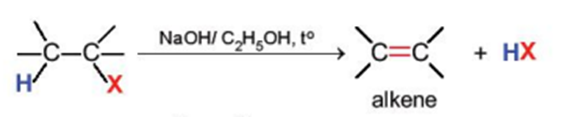
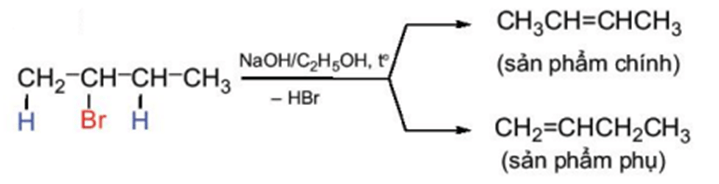
2. Phản ứng tách hydrogen halide
Các dẫn xuất monohalogen của alkane có thể bị tách hydrogen halide để tạo thành alkene theo sơ đồ sau:
Phản ứng này xảy ra khi đun nóng dẫn xuất halogen với base mạnh như NaOH, RONa trong dung môi alcohol.
Ví dụ:
Phản ứng tách xảy ra theo quy tắc tách Zaitsev: Trong phản ứng tách hydrogen halide, nguyên tử halogen bị tách ưu tiên cùng với nguyên tử hydrogen ở carbon bên cạnh có bậc cao hơn.
Ví dụ:
V. Ứng dụng
1. Một số ứng dụng tiêu biểu của dẫn xuất halogen
- Sản xuất vật liệu polymer;
- Sản xuất dược phẩm; dung môi.
- Tác nhân làm lạnh;
- Sản xuất thuốc bảo vệ thực vật; chất kich thích sinh trưởng.
2. Dẫn xuất halogen với sức khoẻ và môi trường
a) CFC và tầng ozone
Một số dẫn xuất halogen chứa đồng thời chlorine, fluorine được gọi chung là chlorofluorocarbon (viết tắt là CFC). Các hợp chất này trước đây được sử dụng phổ biến trong các hệ thống làm lạnh như tủ lạnh, máy điều hoà nhiệt độ, hệ thống làm lạnh công nghiệp chất đẩy trong các bình xịt,... Tuy nhiên do ảnh hưởng gây hại đến tầng ozone nên CFC bị hạn chế và cấm sử dụng. Hiện nay CFC được thay thế bởi các dẫn xuất halogen không chứa chlorine như hydrofluorocarbon (HFC), hydrofluoroolefin (HFO).
b) Thuốc trừ sâu, thuốc diệt cỏ và chất kích thích sinh trưởng thực vật
Nhiều dẫn xuất của chlorine trước đây được sử dụng phổ biến trong nông nghiệp dùng làm thuốc bảo vệ thực vật, chất kích thích sinh trưởng.
Tuy nhiên, do đặc tính khó phân huỷ, tồn dư lâu trong môi trường và có tác hại đến sức khoẻ con người nên các loại hợp chất này hiện nay bị hạn chế hoặc bị cấm sử dụng tại nhiều quốc gia.
B. Bài tập
Đang cập nhật......
Xem thêm các bài tóm tắt lý thuyết Hóa 11 Kết nối tri thức hay, chi tiết khác:
Lý thuyết Bài 17: Arene (Hydrocarbon thơm)