Lý thuyết Hóa 11 Bài 15: Alkane
A. Lý thuyết
I. Khái niệm, danh pháp
1. Khái niệm và công thức chung của alkane
Alkane là các hydrocarbon no mạch hở chỉ chứa liên kết đơn (liên kết 𝜎) C – H và C – C trong phân tử.
Công thức chung của alkane: CnH2n + 2 (n là số nguyên, n ≥ 1).
Ví dụ: CH4, C2H6, C3H8 …
2. Danh pháp
a) Alkane không phân nhánh
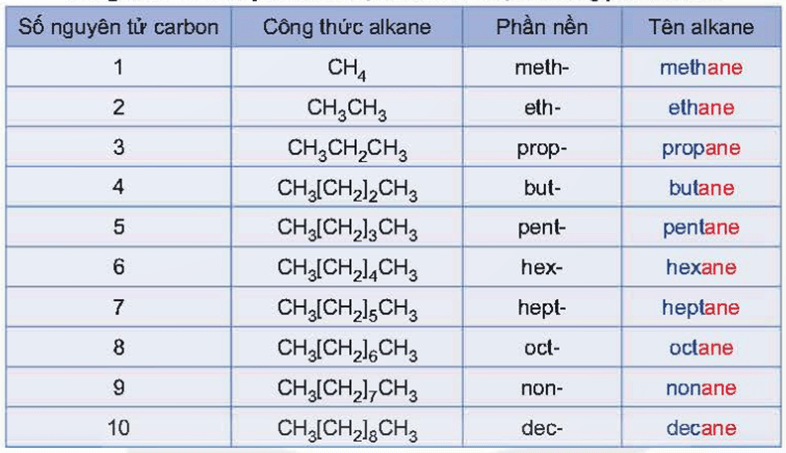
Tên theo danh pháp thay thế của alkane mạch không phân nhánh:
Phần nền (chỉ số lượng nguyên tử carbon) + ane
Tên thay thế của một số alkane mạch không phân nhánh được thể hiện ở bảng sau:
b) Alkane mạch nhánh
- Gốc alkyl: Phần còn lại sau khi lấy đi một nguyên tử hydrogen từ phân tử alkane (công thức chung của gốc alkyl là CnH2n + 1 −).
Tên gốc alkyl: Phần nền (chỉ số lượng nguyên tử carbon) + yl
Ví dụ: CH3−: methyl.
- Alkane mạch nhánh gồm alkane mạch chính kết hợp với một hay nhiều nhánh.
Tên theo danh pháp thay thế của alkane mạch phân nhánh:
Số chỉ vị trí mạch nhánh + tên nhánh + tên alkane mạch chính
Lưu ý:
- Chọn mạch dài nhất, có nhiều nhánh nhất làm mạch chính.
- Đánh số nguyên tử carbon mạch chính sao cho mạch nhánh có số chỉ vị trí nhỏ nhất.
- Dùng chữ số (1, 2, 3, …) và gạch nối (−) để chỉ vị trí nhánh, nhóm cuối cùng viết liền với tên mạch chính.
- Nếu có nhiều nhánh giống nhau: dùng các từ như di- (2), tri- (3), tetra- (4) … để chỉ số lượng nhóm giống nhau; tên nhánh viết theo thứ tự bảng chữ cái.
Ví dụ:
II. Đặc điểm cấu tạo
Trong phân tử alkane chỉ chứa các liên kết đơn C – C và C – H, các liên kết này là liên kết σ bền vững và kém phân cực. Do vậy, phân tử alkane hầu như không phân cực và ở điều kiện thường chúng tương đối trơ về mặt hoá học.
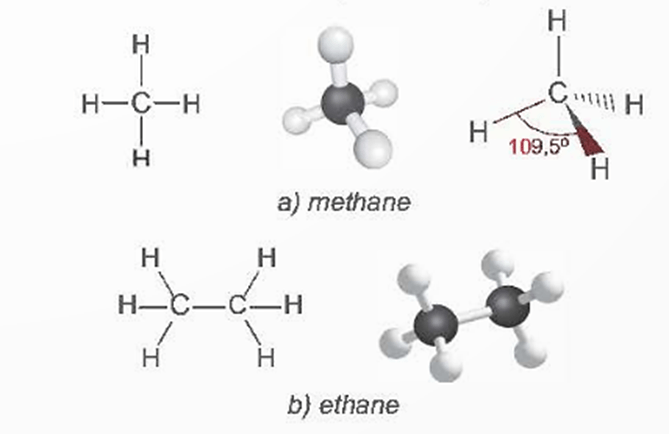
Trong phân tử methane, bốn liên kết C – H giống nhau tạo với nhau một góc 109,5o và hướng về 4 đỉnh của một hình tứ diện đều.
Công thức cấu tạo và mô hình phân tử của methane và ethane được thể hiện như hình sau:
III. Tính chất vật lí
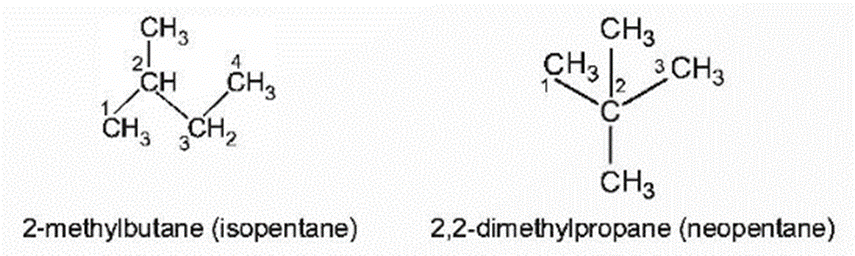
Ở điều kiện thường, alkane từ C1 đến C4 và neopentane ở trạng thái khí, alkane từ C5 đến C17 (trừ neopentane) ở trạng thái lỏng, không màu, alkane từ C18 trở lên là chất rắn màu trắng (còn gọi là sáp paraffin).
Các alkane mạch nhánh thường có nhiệt độ sôi thấp hơn so với đồng phân alkane mạch không phân nhánh. Alkane không tan hoặc tan rất ít trong nước và nhẹ hơn nước, tan tốt hơn trong các dung môi hữu cơ.
IV. Tính chất hoá học
1. Phản ứng thế
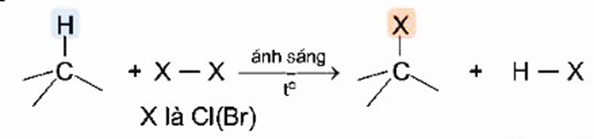
Khi đặt bình chứa hỗn hợp của alkane với halogen (thường là chlorine hoặc bromine) trong phòng tối và ở nhiệt độ phòng, phản ứng không xảy ra. Nhưng nếu đun nóng hoặc chiếu ánh sáng sẽ xảy ra phản ứng thế nguyên tử hydrogen trong alkane bằng nguyên tử halogen:
Phản ứng trên được gọi là phản ứng halogen hóa alkane. Sản phẩm của phản ứng halogen hoá là các dẫn xuất halogen.
Ví dụ:
Chlorine có thể thay thế lần lượt từng nguyên tử H trong phân tử methane.
Phương trình hóa học:
CH4 + Cl2 CH3Cl + HCl
CH3Cl + Cl2 CH2Cl2 + HCl
CH2Cl2 + Cl2 CHCl3 + HCl
CHCl3 + Cl2 CCl4 + HCl
Chú ý: Khi thực hiện phản ứng thế halogen vào các alkane có từ 3 nguyên tử carbon trở lên sẽ thu được hỗn hợp các sản phẩm thế monohalogen.
2. Phản ứng cracking
Cracking alkane là quá trình phân cắt liên kết C–C (bẻ gãy mạch carbon) của các alkane mạch dài để tạo thành hỗn hợp các hydrocarbon có mạch carbon ngắn hơn.
Phản ứng cracking được ứng dụng trong công nghiệp lọc dầu. Phản ứng cracking được thực hiện trong điều kiện nhiệt độ cao và thường có xúc tác.
Ví dụ:
C9H20
3. Phản ứng reforming
Reforming alkane là quá trình chuyển các alkane mạch không phân nhánh thành các alkane mạch phân nhánh và các hydrocarbon mạch vòng nhưng không làm thay đổi số nguyên tử carbon trong phân tử và cũng không làm thay đổi đáng kể nhiệt độ sôi của chúng.
Reforming alkane xảy ra quá trình đồng phân hoá (isomer hóa) và arene hoá (thơm hoá). Quá trình reforming thường được thực hiện với các alkane từ C5 đến C11 trong điều kiện nhiệt độ cao và thường có xúc tác.
Quá trình reforming được ứng dụng trong công nghiệp lọc dầu để làm tăng chỉ số octane của xăng và sản xuất các arene (benzene, toluene, xylene) làm nguyên liệu cho công nghiệp tổng hợp hữu cơ.
4. Phản ứng oxi hoá
a) Phản ứng oxi hoá hoàn toàn (phản ứng cháy)
Khi tiếp xúc với oxygen và có tia lửa khơi mào, alkane bị đốt cháy tạo thành khí carbon dioxide, hơi nước và giải phóng năng lượng.
Tổng quát:
CnH2n + 2 + O2 nCO2 + (n + 1)H2O
Phản ứng cháy của alkane có vai trò rất quan trọng đối với đời sống con người. Đốt cháy các alkane cung cấp nhiệt để đun nấu, sưởi ấm và cung cấp năng lượng cho các ngành công nghiệp.
b) Phản ứng oxi hoá không hoàn toàn
Ở nhiệt độ cao, có mặt xúc tác, alkane bị oxi hoá cắt mạch carbon bởi oxygen tạo thành hỗn hợp carboxylic acid:
RCH2 – CH2R’ + O2 RCOOH + R’COOH + H2O
Các acid béo mạch dài dùng để sản xuất xà phòng và các chất tẩy rửa được điều chế bằng phương pháp oxi hoá cắt mạch các alkane C25 – C35.
V. Ứng dụng
Khí thiên nhiên và khí dầu mỏ là nhiên liệu sạch và được sử dụng rộng rãi trên thế giới. Chúng được sử dụng làm nhiên liệu trong sản xuất và đời sống.
LPG (Liquefied Petroleum Gas) thương phẩm chứa propane C3H8 và butane C4H10.
Ngoài ra, khí thiên nhiên và khí dầu mỏ với thành phần chính là methane được dùng làm nguyên liệu để sản xuất phân bón urea, hydrogen và ammonia.
Các alkane lỏng được sử dụng làm nhiên liệu xăng, diesel và nhiên liệu phản lực (jet fuel)....
Các alkane C6, C7, C8 là nguyên liệu để sản xuất benzene, toluene và các đồng phân xylene.
Các alkane từ C11 đến C20 (vaseline) được dùng làm kem dưỡng da, sáp nẻ, thuốc mỡ. Các alkane từ C20 đến C35 (paraffin) được dùng làm nến, sáp....
VI. Điều chế
1. Phương pháp điều chế alkane ở thể khí trong công nghiệp
Các alkane ở thể khí chủ yếu lấy từ khí thiên nhiên và khí dầu mỏ. Sau khi loại bỏ các hợp chất không phải là hydrocarbon khí được dẫn qua đường ống đến nơi tiêu thụ hoặc nén lại ở dạng lỏng để dễ dàng vận chuyển.
Khí dầu mỏ hoá lỏng là LPG, còn khí thiên nhiên hoá lỏng là LNG.
2. Phương pháp điều chế alkane ở thể lỏng trong công nghiệp
Khi chưng cất dầu mỏ nhận được hỗn hợp alkane có chiều dài mạch carbon khác nhau ở các phân đoạn sôi khác nhau. Để nhận được các alkane tinh khiết cần phải có các công nghệ tách và tinh chế rất phức tạp.
VII. Ô nhiễm không khí do phương tiện giao thông
1. Các chất trong khí thải của phương tiện giao thông gây ô nhiễm không khí
Quá trình cháy của xăng, dầu diesel trong động cơ các phương tiện giao thông tạo ra sản phẩm cuối cùng là CO2. Khí này là nguyên nhân chính gây hiệu ứng nhà kính làm Trái Đất nóng lên. Nếu xăng, dầu diesel cháy không hoàn toàn, thiếu oxygen thì tạo ra khí CO, VOCs (các hợp chất hữu cơ dễ bay hơi như fomaldehyde, benzene, toluene,...) và các hạt bụi đen chứa các hợp chất arene đa vòng rất độc. Nhiên liệu chứa sulfur khi cháy sinh ra các oxide của sulfur SOx. Ngoài ra quá trình cháy tạo nhiệt độ cao khiến oxygen và nitrogen trong không khí phản ứng với nhau, tạo thành các loại oxide của nitrogen (NOx). Các chất này gây ô nhiễm môi trường không khí.
2. Một số biện pháp hạn chế ô nhiễm môi trường do các phương tiện giao thông
- Sử dụng nhiên liệu cháy sạch: Để bảo vệ sức khoẻ con người, trong tiêu chuẩn nhiên liệu có yêu cầu nghiêm ngặt về chỉ số octane (đối với xăng và chỉ số cetane đối với diesel. Ngoài ra còn có yêu cầu về hàm lượng kim loại nặng.
- Sử dụng nhiên liệu sinh học như xăng pha thêm ethanol (E5, E10,...), biodiesel. Ethanol vừa là phụ gia tăng chỉ số octane vừa là nhiên liệu cháy sạch. Biodiesel là methyl ester của các acid béo trong dầu mỡ động thực vật phi thực phẩm, nhiên liệu này có chỉ số cetane cao, không chứa sulfur và arene.
- Sử dụng các phương tiện giao thông tiết kiệm năng lượng và chuyển đổi sang các loại động cơ điện.
B. Bài tập
Đang cập nhật......
Xem thêm các bài tóm tắt lý thuyết Hóa 11 Kết nối tri thức hay, chi tiết khác:
Lý thuyết Bài 13: Cấu tạo hoá học hợp chất hữu cơ
Lý thuyết Bài 14: Ôn tập chương 3
Lý thuyết Bài 16: Hydrocarbon không no