Giải Hóa học 11 Bài 1: Khái niệm về cân bằng hóa học
Lời giải:
- Các phản ứng này được gọi là phản ứng thuận nghịch.
- Để tăng hiệu suất của các phản ứng này cần vận dụng nguyên lí Le Chatelier: Một phản ứng thuận nghịch đang ở trạng thái cân bằng khi chịu một tác động từ bên ngoài như biến đổi nồng độ, áp suất, nhiệt độ thì cân bằng sẽ chuyển dịch theo chiều làm giảm tác động đó.
1. Phản ứng một chiều, phản ứng thuận nghịch và cân bằng hóa học
Lời giải:
Phản ứng điều chế oxygen từ KMnO4:
2KMnO4 to→ K2MnO4 + MnO2 + O2↑
Phản ứng này là phản ứng một chiều do đó phản ứng không xảy ra theo chiều ngược lại (tức K2MnO4, MnO2 và O2 không thể phản ứng được với nhau tạo lại KMnO4).
Luyện tập trang 5 Hóa học 11: Viết phương trình hoá học của một số phản ứng một chiều mà em biết.
Lời giải:
Ví dụ một số phản ứng một chiều:
HCl + NaOH → NaCl + H2O;
Fe + 2HCl → FeCl2 + H2↑;
Na2CO3 + BaCl2 → BaCO3↓ + 2NaCl.
Lời giải:
Phản ứng Cl2 tác dụng với nước:
Cl2(g) + H2O(l) ⇌ HCl(aq) + HClO(aq)
Điểm khác giữa hai phản ứng:
- Phản ứng nhiệt phân thuốc tím là phản ứng một chiều;
- Phản ứng Cl2 tác dụng với nước là phản ứng thuận nghịch.
Luyện tập trang 6 Hóa học 11: Trên thực tế có các phản ứng sau:
2H2 + O2 → 2H2O (1)
2H2O dienphan→ 2H2 + O2 (2)
Vậy có thể viết:
2H2 + O2 ⇌ 2H2O được không? Tại sao?
Lời giải:
Không thể viết 2H2 + O2 ⇌ 2H2O do phản ứng (1) và (2) xảy ra ở hai điều kiện khác nhau.
Chú ý: Phản ứng thuận nghịch được xét trong cùng một điều kiện xác định.
Lời giải:
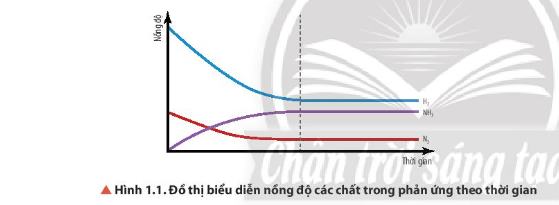
- Ban đầu:
+ Nồng độ các chất tham gia (N2, H2) giảm dần theo thời gian.
+ Nồng độ chất sản phẩm (NH3) tăng dần theo thời gian.
- Sau một thời gian nồng độ các chất tham gia và chất sản phẩm không thay đổi (giữ nguyên) theo thời gian (đồ thị được biểu diễn bằng đường thẳng).
Lời giải:
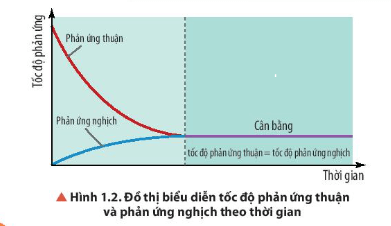
- Ban đầu:
+ Tốc độ phản ứng thuận giảm dần;
+ Tốc độ phản ứng nghịch tăng dần;
- Đến thời điểm cân bằng: Tốc độ phản ứng thuận = tốc độ phản ứng nghịch.
2. Hằng số cân bằng của phản ứng thuận nghịch
Lời giải:
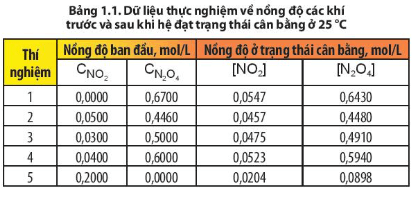
- Thí nghiệm 1: [N2O4][NO2]2=0,6430,05472=214,9
- Thí nghiệm 2: [N2O4][NO2]2=0,4480,04572=214,51
- Thí nghiệm 3: [N2O4][NO2]2=0,4910,04752=217,62
- Thí nghiệm 4: [N2O4][NO2]2=0,5940,05232=217,16
- Thí nghiệm 5: [N2O4][NO2]2=0,08980,02042=215,78
Nhận xét: Các giá trị thu được là xấp xỉ nhau.
aA + bB ⇌ cC + dD
Lập tỉ lệ giữa hằng số tốc độ phản ứng thuận và hằng số tốc độ phản ứng nghịch ở trạng thái cân bằng.
Lời giải:
Tốc độ phản ứng thuận: vt=kt.CaA.CbB
Tốc độ phản ứng nghịch: vn=kn.CcC.CdD
Ở trạng thái cân bằng: vt = vn hay kt.CaA.CbB=kn.CcC.CdD
⇒ktkn=CcC.CdDCaA.CbB=[C]c.[D]d[A]a.[B]b
Luyện tập trang 7 Hóa học 11: Cho hệ cân bằng nhau:
2SO2(g) + O2(g) ⇌ 2SO3(g)
Viết biểu thức tính hằng số cân bằng Kc của phản ứng trên.
Lời giải:
Hệ cân bằng: 2SO2(g) + O2(g) ⇌ 2SO3(g)
Biểu thức tính hằng số cân bằng: KC=[SO3]2[SO2]2.[O2].
3. Sự chuyển dịch cân bằng hóa học
Lời giải:
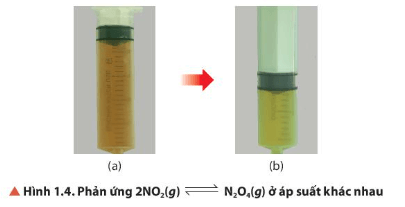
- Hiện tượng:
+ Màu của hỗn hợp khí trong bình 2 nhạt dần.
+ Màu của hỗn hợp khí trong bình 3 đậm dần.
- Nhận xét:
2NO2(g) ⇌ N2O4(g)
(màu nâu đỏ) (không màu)
+ Cân bằng trong bình 2 chuyển dịch theo chiều thuận;
+ Cân bằng trong bình 3 chuyển dịch theo chiều nghịch.
Câu hỏi thảo luận 8 trang 8 Hóa học 11: Nhận xét hiện tượng xảy ra trong Thí nghiệm 2.
Lời giải:
Đun nhẹ bình (1) thấy màu của hỗn hợp trong bình (1) đậm dần lên.
Lời giải:
CH3COONa(aq) + H2O(l) ⇌ CH3COOH(aq) + NaOH(aq)
Nhận xét: Khi đun nóng, phản ứng trong bình (1) chuyển dịch theo chiều thuận.
4. Các yếu tố ảnh hưởng đến cân bằng hóa học
Lời giải:
Phản ứng (1): 2NO2(g) ⇌ N2O4(g) ∆
(màu nâu đỏ) (không màu)
< 0.
Vậy ở phản ứng (1), chiều thuận toả nhiệt, chiều nghịch thu nhiệt.
Lời giải:
- Khi làm lạnh bình (2) cân bằng trong bình chuyển dịch theo chiều phản ứng toả nhiệt.
- Khi làm nóng bình (3) cân bằng trong bình chuyển dịch theo chiều phản ứng thu nhiệt.
CaCO3(s) ⇌ CaO(s) + CO2(g) .
Để nâng cao hiệu suất phản ứng sản xuất vôi, cần điều chỉnh nhiệt độ như thế nào? Giải thích.
Lời giải:
> 0. Phản ứng thuận thu nhiệt.
Để nâng cao hiệu suất phản ứng sản xuất vôi, cần nâng cao nhiệt độ (thực tế cho thấy nâng nhiệt độ khoảng 1000 oC) khi đó cân bằng sẽ chuyển dịch theo chiều phản ứng thu nhiệt, tức chiều thuận, làm tăng hiệu suất phản ứng.
Ngoài ra, phản ứng nung vôi cần được cung cấp nhiệt liên tục trong suốt quá trình phản ứng.
Lời giải:
2NO2(g) ⇌ N2O4(g)(2)
(màu nâu đỏ) (không màu)
- Khi đẩy pit – tông, thể tích của hệ giảm, màu nâu đỏ nhạt dần, khi đó cân bằng chuyển dịch theo chiều thuận, làm giảm số mol khí.
- Khi kéo pit – tông, thể tích của hệ tăng, màu nâu đỏ đậm dần, khi đó cân bằng chuyển dịch theo chiều nghịch, làm tăng số mol khí.
Luyện tập trang 9 Hóa học 11: Phản ứng tổng hợp ammonia:
N2(g) + 3H2(g) 2NH3(g)
Để thu được NH3 với hiệu suất cao, cần điều chỉnh áp suất như thế nào?
Lời giải:
Trong phản ứng tổng hợp ammonia, khi tăng áp suất cân bằng sẽ chuyển dịch theo chiều làm giảm áp suất tức chiều làm giảm số mol khí, hay chiều thuận.
Như vậy để thu được NH3 với hiệu suất cao, cần điều chỉnh áp suất cao. Thực tế, phản ứng tổng hợp NH3 ở các nhà máy thường được thực hiện ở áp suất 200 – 300 bar.
Lời giải:
Hệ cân bằng (3): C(s) + CO2(g) ⇌ 2CO(g)
Khi thêm một lượng khí CO vào hệ cân bằng (3) cân bằng sẽ chuyển dịch theo chiều làm giảm CO hay chiều nghịch.
CaCO3(s) + H2O(l) + CO2(aq) ⇌ Ca(HCO3)2(aq)
Hãy giải thích các quá trình này.
Lời giải:
- Nước mưa có hoà tan CO2 bào mòn đá vôi (phản ứng xâm thực của nước mưa vào đá vôi): CaCO3(s) + H2O(l) + CO2(aq) → Ca(HCO3)2(aq).
- Sau đó Ca(HCO3)2 chảy nhỏ giọt từ trần hang động, tại đó chúng bị phân huỷ dần tạo thành thạch nhũ:
Ca(HCO3)2(aq) → CaCO3(s) + H2O(l) + CO2(aq).
Bài tập (trang 11)
A. Nồng độ.
B. Nhiệt độ.
C. Áp suất.
D. Chất xúc tác.
Lời giải:
Đáp án đúng là: B
Trong phản ứng thuận nghịch, hằng số cân bằng KC của phản ứng xác định chỉ phụ thuộc vào nhiệt độ.
A. Nhiệt độ.
B. Áp suất.
C. Nồng độ.
D. Chất xúc tác.
Lời giải:
Đáp án đúng là: D
Chất xúc tác không làm thay đổi nồng độ các chất trong hệ cân bằng và cũng không làm thay đổi hằng số cân bằng nên không làm chuyển dịch cân bằng.
Bài 3 trang 11 Hóa học 11: Viết biểu thức tính Kc cho các phản ứng sau:
(1) CaCO3(s) ⇌ CaO(s) + CO2(g)
(2) Cu2O(s) + (g) ⇌ 2CuO(g)
Lời giải:
Chú ý: Chất rắn không xuất hiện trong biểu thức hằng số cân bằng.
a)
b)
Bài 4 trang 11 Hóa học 11: Xét các hệ cân bằng sau trong một bình kín:
a) C(s) + H2O(g) ⇌ CO(g) + H2(g)
b) CO(g) + H2O(g) ⇌ CO2(g) + H2(g)
Các cân bằng trên dịch chuyển theo chiều nào khi thay đổi một trong các điều kiện sau?
(1) Tăng nhiệt độ.
(2) Thêm một lượng hơi nước vào hệ.
(3) Thêm khí H2 vào hệ.
(4) Tăng áp suất chung bằng cách nén cho thể tích của hệ giảm xuống.
(5) Dùng chất xúc tác.
Lời giải:
a) C(s) + H2O(g) ⇌ CO(g) + H2(g)
(1) Tăng nhiệt độ cân bằng chuyển dịch theo chiều phản ứng thu nhiệt tức chiều thuận.
(2) Thêm một lượng hơi nước vào hệ, cân bằng chuyển dịch theo chiều làm giảm lượng hơi nước tức chiều thuận.
(3) Thêm khí H2 vào hệ, cân bằng chuyển dịch theo chiều làm giảm lượng H2 tức chiều nghịch.
(4) Tăng áp suất chung bằng cách nén cho thể tích của hệ giảm xuống cân bằng chuyển dịch theo chiều giảm số mol khí thức chiều nghịch.
(5) Dùng chất xúc tác không làm cân bằng chuyển dịch.
b) CO(g) + H2O(g) ⇌ CO2(g) + H2(g)
(1) Tăng nhiệt độ cân bằng chuyển dịch theo chiều phản ứng thu nhiệt tức chiều nghịch.
(2) Thêm một lượng hơi nước vào hệ, cân bằng chuyển dịch theo chiều làm giảm lượng hơi nước tức chiều thuận.
(3) Thêm khí H2 vào hệ, cân bằng chuyển dịch theo làm giảm lượng H2 tức chiều nghịch.
(4) Tăng áp suất chung bằng cách nén cho thể tích của hệ giảm xuống không làm cân bằng chuyển dịch do hệ cân bằng có tổng hệ số tỉ lượng của các chất khí ở hai vế của phương trình hoá học bằng nhau.
(5) Dùng chất xúc tác không làm cân bằng chuyển dịch.
Bài 5 trang 11 Hóa học 11: Cho phản ứng sau:
COCl2(g) ⇌ CO(g) + Cl2(g) KC = 8,2×10-2 ở 900 K.
Tại trạng thái cân bằng, nếu nồng độ CO và Cl2 đều bằng 0,15 M thì nồng độ COCl2 là bao nhiêu?
Lời giải:
Áp dụng công thức:
Xem thêm các bài giải SGK Hóa lớp 11 Chân trời sáng tạo hay, chi tiết khác: