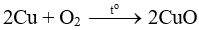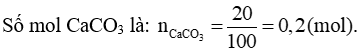Giải SBT Khoa học tự nhiên 8 Bài 11: Oxide
A. 1. B. 2. C. 3. D. 4.
Lời giải:
Đáp án đúng là: D
Có 4 oxide trong dãy là: CaO; CO2; MgO; CuO.
A. 3. B. 4. C. 5. D. 6.
Lời giải:
Đáp án đúng là: B
Các basic oxide/oxide base là: CaO; FeO; MgO; Na2O.
A. Khí N2 bị lẫn hơi nước. B. Khí CO bị lẫn hơi nước.
C. Khí SO2 bị lẫn hơi nước. D. Khí H2 bị lẫn hơi nước.
Lời giải:
Đáp án đúng là: C
Vì NaOH có phản ứng hóa học với SO2.
2NaOH + SO2 → Na2SO3 + H2O
Lời giải:
* Hai basic oxide/oxide base:
- CuO: Copper(II) oxide.
- CaO: Calcium oxide.
* Hai acidic oxide/oxide acid:
- P2O5: Diphosphorus pentoxide.
- SO2: Sulfur dioxide.
* Hai oxide lưỡng tính
- Al2O3: Aluminium oxide.
- ZnO: Zinc oxide.
Bài 11.5 trang 25 Sách bài tập KHTN 8: Cho các chất sau CuO; MgO; CO2; Fe2O3; SO2; CaO; Na2O; SO3.
a) Chất nào trong các chất trên phản ứng được với dung dịch KOH?
b) Chất nào trong các chất trên phản ứng được với dung dịch HCl?
Viết các phương trình hóa học minh họa.
Lời giải:
a) Các chất phản ứng được với dung dịch KOH là: CO2, SO2, SO3.
Các phương trình hóa học của phản ứng xảy ra:
CO2 + 2KOH → K2CO3 + H2O
SO2 + 2KOH → K2SO3 + H2O
SO3 + 2KOH → K2SO4 + H2O
b) Các chất phản ứng được với dung dịch HCl là: CuO, MgO, Fe2O3, CaO, Na2O.
Các phương trình hóa học của phản ứng xảy ra:
CuO + 2HCl → CuCl2 + H2O
MgO + 2HCl → MgCl2 + H2O
Fe2O3 + 6HCl → 2FeCl3 + 3H2O
CaO + 2HCl → CaCl2 + H2O
Na2O + 2HCl → 2NaCl + H2O
Lời giải:
Các phương trình hóa học:
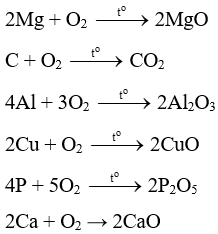
4K + O2 → 2K2O
Lời giải:
Các phương trình hóa học của phản ứng:
CuO + H2SO4 → CuSO4 + H2O
CO2 + 2NaOH → Na2CO3 + H2O
SO2 + 2KOH → K2CO3 + H2O.
Lời giải:
Lớp màng rắn hình thành trên bề mặt nước vôi trong khi để trong không khí là CaCO3, được tạo thành do Ca(OH)2 tác dụng với CO2 trong không khí.
Phương trình hoá học:
Ca(OH)2 + CO2 → CaCO3↓ + H2O.
Bài 11.9 trang 26 Sách bài tập KHTN 8: Chia mẩu dây đồng thành hai phần bằng nhau.
- Phần 1 cho vào dung dịch HCl, không thấy hiện tượng gì xảy ra.
- Phần 2 đem đốt nóng trong không khí, một thời gian sau thu được chất rắn màu đen. Khi cho vào trong dung dịch HCl, thấy chất rắn màu đen tan ra và dung dịch có màu xanh.
Giải thích các hiện tượng diễn ra trong các quá trình trên. Viết phương trình hóa học của phản ứng xảy ra (nếu có).
Lời giải:
Phần 1: Cu không tác dụng với dung dịch HCl.
Phẩn 2: Khi đốt nóng dây đồng (Cu) trong không khí sẽ có phản ứng:
CuO có màu đen, khi cho vào dung dịch HCl có phản ứng:
CuO + 2HCl → CuCl2 + H2O
CuCl2 vừa tạo thành tan trong nước tạo ra dung dịch có màu xanh.
Lời giải:
Khi cho dung dịch HCl loãng lên bề mặt sắt bị gỉ, xảy ra các phản ứng của HCl với FeO và Fe2O3 tạo ra các muối FeCl2 và FeCl3 tan trong nước, vì vậy, bề mặt sắt được làm sạch gỉ.
Các phương trình hóa học minh họa:
FeO + 2HCl → FeCl2 + H2O
Fe2O3 + 6HCl → 2FeCl3 + 3H2O
Lời giải:
Phương trình hóa học: CO2 + CaCO3 → CaCO3 ¯ + H2O
Từ phương trình hóa học tính được số mol CO2 bằng số mol CaCO3 và bằng 0,2 mol.
Từ đó tính được thể tích khí CO2 đã phản ứng là: 0,2 .24,79 = 4,958 lít.
CaCO3 CaO + CO2
Để tạo ra được 7 tấn CaO cần phải dùng bao nhiêu tấn quặng đá vôi (chứa 80% CaCO3) và sinh ra bao nhiêu kg khí CO2?
Lời giải:
CaCO3 CaO + CO2
100g 56g
x tấn 7 tấn
- Dựa vào phương trình hóa học tạo ra CaO từ CaCO3, tính được khối lượng CaCO3 cần dùng là 12,5 tấn, khối lượng CO2 tạo ra là 12,5 – 7,5 = 5,5 tấn (5500 kg).
- Gọi lượng quặng chứa 80% CaCO3 cần dùng là a, ta có:
Từ đó tính được a = 15,625 tấn.
a) Xác định công thức của oxide nói trên, biết kim loại R có hóa trị II và phần trăm khối lượng của kim loại R trong oxide là 60%.
b) Viết phương trình hóa học của phản ứng xảy ra trong quá trình trên và cho biết oxide được tạo thành thuộc loại oxide nào. Giải thích.
c) Nêu một số ứng dụng của oxide trên trong thực tiễn.
Lời giải:
a) Đặt công thức của oxide là RO.
%mR = 60% =>
Vậy kim loại R là magnesium, Mg.
Công thức oxide là MgO.
b) Phương trình hoá học:
2Mg + O2 MgO.
MgO là oxide base/ basic oxide.
c) Một số ứng dụng của MgO:
- MgO được dùng làm chất trợ lưu hóa trong cao su tổng hợp Polychloroprene (CR), cũng là chất xúc tác tổng hợp Polyphenyleneoxide, các miếng đệm của sơn và giấy.
- MgO được sử dụng rộng rãi như một chất cách điện trong cáp điện chịu nhiệt.
- MgO là thành phần chính trong các lò sản xuất sắt và thép, các kim loại màu, thủy tinh hay xi măng vì chịu được nhiệt độ rất cao.
- MgO là một thành phần chống cháy chính trong các vật liệu xây dựng với đặc tính nổi bật là chống cháy, chống mối, chống ẩm, chống nấm mốc và kháng nấm mốc, và độ bền.
- MgO là một trong những thành phần của xi măng Portland trong các nhà máy chế biến khô.
- MgO còn được ứng dụng trong công nghệ gốm với tác dụng là chất trợ chảy và tăng khả năng chống rạn men.
- MgO được sử dụng rộng rãi trong việc xử lý đất, nước ngầm, xử lý nước thải, xử lý nước uống bằng cách ổn định độ pH.
- MgO được sử dụng để làm dịu cơn đau ợ nóng và chua của chứng đau dạ dày.
Xem thêm lời giải Sách bài tập Khoa học tự nhiên 8 sách Cánh diều hay, chi tiết khác: