Đề cương Học kì 2 Hóa học 10 Cánh diều
I. Kiến thức ôn tập
CHỦ ĐỀ 4: PHẢN ỨNG OXI HÓA - KHỬ
1. Khái niệm số oxi hóa và cách xác định của số oxi hóa của nguyên tử các nguyên tố.
2. Khái niệm phản ứng oxi hóa - khử, chất khử, chất oxi hóa, quá trình khử, quá trình oxi hóa.
3. Cân bằng phản ứng oxi hóa - khử theo phương pháp thăng bằng electron.
4. Ý nghĩa và một số phản ứng oxi hóa – khử quan trọng.
CHỦ ĐỀ 5: NĂNG LƯỢNG HÓA HỌC
1. Khái niệm phản ứng tỏa nhiệt, phản ứng thu nhiệt, điều kiện chuẩn, enthalpy tạo thành chuẩn của
một chất hóa học và biến thiên enthalpy chuẩn của phản ứng hóa học.
2. Ý nghĩa về dấu và giá trị của biến thiên enthalpy phản ứng.
3. Cách tính biến thiên enthalpy phản ứng theo enthalpy tạo thành, năng lượng liên kết.
CHỦ ĐỀ 6: TỐC ĐỘ PHẢN ỨNG HÓA HỌC
1. Khái niệm tốc độ phản ứng, tốc độ trung bình của phản ứng.
2. Định luật tác dụng khối lượng.
3. Các yếu tố ảnh hưởng tới tốc độ phản ứng, ý nghĩa của hệ số nhiệt độ Van’t Hoff.
4. Cách tính tốc độ trung bình của phản ứng theo hằng số tốc độ phản ứng và nồng độ.
CHỦ ĐỀ 7: NGUYÊN TỐ NHÓM VIIA (NHÓM HALOGEN)
1. Khái quát nhóm Halogen, trạng thái tự nhiên. Đơn chất Halogen: tính chất vật lí, tính chất hóa học, điều chế, ứng dụng.
2. Hydrogen halide: tính chất vật lí, ứng dụng.
3. Hydrohalic acid: tính chất vật lí, tính chất hóa học.
4. Tính khử của một số ion halide X-, phân biệt các ion halide X
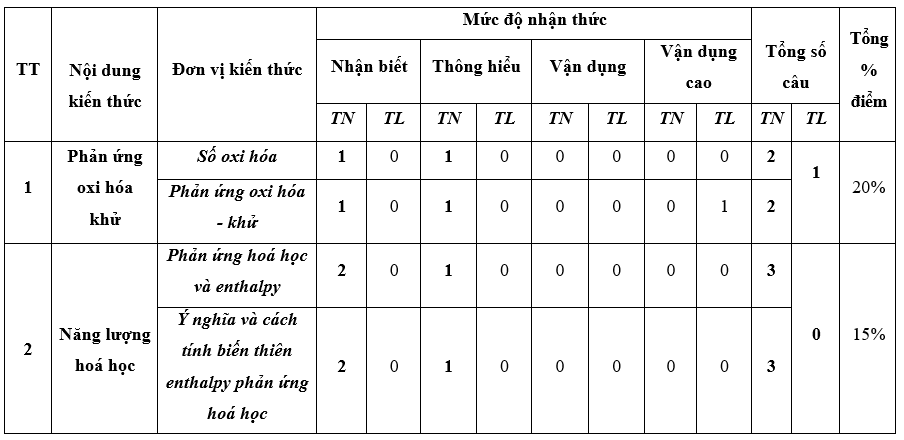
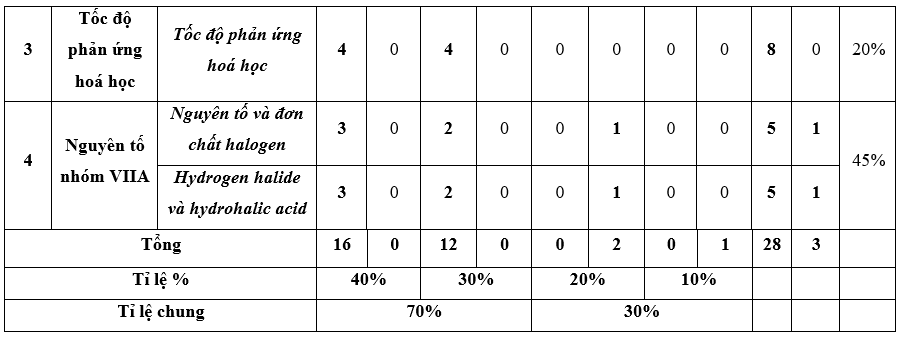
II. Ma trận đề thi
Ma trận đề kiểm tra cuối kì 2 - Hóa học 10 – Cánh diều
III. Câu hỏi ôn tập
Xem chi tiết trong file đính kèm cuối bài viết.
IV. Đề thi minh họa
Đề số 1
Phần I: Trắc nghiệm (7 điểm)
Câu 1: Số oxi hoá của nitrogen trong hợp chất NO là
A. +1. B. +2.
C. +3. D. +4.
Câu 2: Cho các hợp chất sau: CO; CO2; NaHCO3; CH4; K2CO3. Số hợp chất trong đó C có số oxi hoá +4 là
A. 5. B. 4.
C. 2. D. 1.
Câu 3: Chất bị khử là
A. chất nhận electron.
B. chất nhường electron.
C. chất có số oxi hoá tăng lên sau phản ứng.
D. chất có số oxi hoá không đổi sau phản ứng.
Câu 4: Cho phản ứng hoá học sau: 3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O. Vai trò của HNO3 trong phản ứng hoá học này là
A. chất khử.
B. chất oxi hoá.
C. môi trường phản ứng.
D. vừa là chất oxi hoá, vừa là môi trường tạo muối.
Câu 5: Cho các phản ứng hoá học sau:
(a) Phản ứng nung vôi.
(b) Phản ứng trung hoà acid – base.
(c) Phản ứng nhiệt phân KClO3.
(d) Phản ứng đốt cháy cồn trong không khí.
Số phản ứng toả nhiệt là
A. 1. B. 2.
C. 3. D. 4.
Câu 6: Phản ứng thu nhiệt là
A. phản ứng giải phóng năng lượng dưới dạng nhiệt.
B. phản ứng hấp thụ năng lượng dưới dạng nhiệt.
C. phản ứng làm tăng nhiệt độ môi trường.
D. phản ứng không có sự trao đổi năng lượng với môi trường.
Câu 7: Cho các phát biểu sau:
(a) Phản ứng xảy ra khi pin được sử dụng trong điện thoại giải phóng năng lượng dưới dạng điện năng.
(b) Biến thiên enthalpy chuẩn của một phản ứng hoá học kí hiệu là ΔfH0298.
(c) Enthalpy tạo thành chuẩn của các đơn chất bền nhất đều bằng 0.
(d) Phản ứng tạo gỉ kim loại là phản ứng toả nhiệt.
Số phát biểu đúng là
A. 1. B. 2.
C. 3. D. 4.
Câu 8: Cho phản ứng:
2NaCl (s) → 2Na (s) + Cl2 (g) (*)
Biết ΔfH0298(NaCl)=−411,2 (kJmol−1). Nhận xét nào sau đây là đúng?
A. Phản ứng (*) toả nhiệt.
B. Phản ứng (*) thu nhiệt.
C. Nhiệt lượng toả ra của phản ứng (*) là 411,2 kJ.
D. Nhiệt lượng thu vào của phản ứng (*) là 411,2 kJ.
Câu 9: Cho các phương trình nhiệt hóa học sau:
(1) CaCO3(s) → CaO(s) + CO2(g) ΔrH0298=+176,0 kJ
(2) CH4(g) + 2O2(g) → CO2(g) + 2H2O(l) ΔrH0298=−890,0 kJ
(3) C(graphite) + O2 (g) → CO2 (g) ΔrH0298=−393,5 kJ
(4) Fe2O3(s) + 2Al(s) → Al2O3(s) + 2Fe(s) ΔrH0298=−851,5 kJ
Số phản ứng thu nhiệt trong các phản ứng trên là
A. 1. B. 2.
C. 3. D. 4.
Câu 10: Cho phản ứng sau: H2(g) + Cl2(g) → 2HCl(g). Biến thiên enthalpy chuẩn của phản ứng là
Cho: Eb (H – H) = 436 kJ/mol, Eb (Cl – Cl) = 243 kJ/mol, Eb (H – Cl) = 432 kJ/ mol.
A. +158 kJ.
B. -158 kJ.
C. +185 kJ.
D. -185 kJ.
Câu 11: Cho hai mảnh Mg có cùng khối lượng vào hai ống nghiệm chứa cùng thể tích dung dịch HCl dư, nồng độ dung dịch HCl ở mỗi ống nghiệm là 2M và 0,5M như hình vẽ dưới đây.
Nhận xét đúng là
A. Mảnh Mg ở ống nghiệm (b) tan hết trước.
B. Mảnh Mg ở ống nghiệm (a) tan hết trước.
C. Thể tích khí thoát ra ở ống nghiệm (a) nhiều hơn.
D. Thể tích khí thoát ra ở ống nghiệm (b) nhiều hơn.
Câu 12: Khi cho một lượng xác định chất phản ứng vào bình để cho phản ứng hoá học xảy ra, tốc độ phản ứng sẽ
A. không đổi cho đến khi kết thúc.
B. tăng dần cho đến khi kết thúc.
C. chậm dần cho đến khi kết thúc.
D. tuân theo định luật tác dụng khối lượng.
Câu 13: Với phản ứng đơn giản có dạng: aA + bB → sản phẩm. Tốc độ phản ứng được tính theo công thức là
A. υ=CA.CB.
B. υ=k.CA.CB.
C. υ=CaA.CbB.
D. υ=k.CaA.CbB.
Câu 14: Nếu chia một vật thành nhiều phẩn nhỏ hơn thì diện tích bề mặt sẽ:
A. tăng lên.
B. giảm đi.
C. không thay đổi.
D. không xác định được.
Câu 15: Phản ứng 3H2 + N2 → 2NH3 có tốc độ mất đi của H2 so với tốc độ hình thành NH3 như thế nào?
A. Bằng 12.
B. Bằng 32.
C. Bằng 23.
D. Bằng 13.
Câu 16: Cho phản ứng phân hủy N2O5 như sau: 2N2O5(g) → 4NO2(g) + O2(g). Nồng độ ban đầu của NO2 là 0 M, sau 100 s là 0,0062 M. Tốc độ trung bình của phản ứng trong 100 s đầu tiên là
A. 1,55.10-5 (M phút-1).
B. 1,35.10-5 (M s-1).
C. 1,35.10-5 (M phút-1).
D. 1,55.10-5 (M s-1).
Câu 17: Hãy cho biết việc sử dụng chất xúc tác đã được áp dụng cho quá trình nào sau đây?
A. Khi ủ bếp than, người ta đậy nắp bếp lò làm cho phản ứng cháy của than chậm lại.
B. Phản ứng oxi hóa SO2 thành SO3 diễn ra nhanh hơn khi có mặt V2O5.
C. Bột nhôm (aluminum) phản ứng với dung dịch HCl nhanh hơn so với dây nhôm.
D. Người ta chẻ nhỏ củi để bếp lửa cháy mạnh hơn.
Câu 18: Khi nhiệt độ tăng thêm 10oC, tốc độ phản ứng hoá học tăng lên 3 lần. Để tốc độ phản ứng đó (đang tiến hành ở 30oC) tăng lên 27 lần thì cần thực hiện phản ứng ở nhiệt độ bao nhiêu?
A. 40 oC. B. 50 oC.
C. 60 oC. D. 70 oC.
Câu 19: Nhóm halogen ở vị trí nào trong bảng tuần hoàn các nguyên tố hoá học?
A. VA. B. VIIA.
C. VIA. D. IVA.
Câu 20: Halogen nào sau đây là chất lỏng ở điều kiện thường?
A. Fluorine.
B. Chlorine.
C. Bromine.
D. Iodine.
Câu 21: Trong nhóm halogen, khả năng oxi hóa của các đơn chất biến đổi theo chiều
A. tăng dần từ fluorine đến iodine.
B. giảm dần từ fluorine đến iodine.
C. không thay đổi khi đi từ fluorine đến iodine.
D. tăng dần từ chlorine đến iodine.
Câu 22: Phương trình hoá học nào sau đây là sai?
A. H2(g) + Cl2(g) → 2HCl(g).
B. Cl2(aq) + H2O(l) ⇄ HCl(aq) + HClO(aq).
C. Cl2(aq) + 2NaBr(aq) → 2NaCl(aq) + Br2(aq).
D. F2(aq) + 2NaCl(aq) → 2NaF(aq) + Cl2(aq).
Câu 23: Cho một lượng halogen X2 tác dụng hết với Mg ta thu được 19 gam magnesium halide. Cũng lượng halogen đó tác dụng hết với Al tạo ra 17,8 gam aluminium halide. Tên và khối lượng của halogen trên là
A. chlorine; 7,1 gam.
B. chlorine; 14,2 gam.
C. bromine; 7,1 gam.
D. bromine; 14,2 gam.
Câu 24: Trong các phát biểu sau. Phát biểu đúng là
A. Iodine có bán kính nguyên tử lớn hơn bromine.
B. Dung dịch NaF phản ứng với dung dịch AgNO3 sinh ra AgF kết tủa.
C. Fluorine có tính oxi hoá yếu hơn chlorine.
D. Acid HBr có tính acid yếu hơn acid HCl.
Câu 25: Dung dịch axit nào sau đây không thể chứa trong bình thủy tinh?
A. HCl.
B. HF .
C. HNO3.
D. H2SO4.
Câu 26: Để trung hoà 100 ml dung dịch NaOH 1,5M thì thể tích dung dịch HCl 0,5M cần dùng là bao nhiêu?
A. 0,5 lít.
B. 0,4 lít.
C. 0,3 lít.
D. 0,6 lít.
Câu 27: Muối nào sau đây tạo kết tủa trắng với AgNO3?
A. KI.
B. CaBr2.
C. NaCl.
D. Na2S.
Câu 28: Hòa tan 1,12 gam iron (Fe) trong dung dịch HCl dư. Sau phản ứng thu được thể tích khí H2 ở điều kiện chuẩn là
A. 0,2479 lít.
B. 0,4958 lít.
C. 0,5678 lít.
D. 1,487 lít.
Phần II: Tự luận (3 điểm)
Câu 1 (1 điểm): Để điều chế khí chlorine (Cl2) trong phòng thí nghiệm, người ta thường cho potassium permanganate (KMnO4) tác dụng với hydrogen chloride (HCl):
KMnO4+ HClto→KCl + MnCl2+ Cl2 + H2O
a) Lập phương trình hóa học của phản ứng hóa học trên bằng phương pháp thăng bằng electron.
b) Giả sử lượng khí chlorine sinh ra được dẫn vào dung dịch chứa muối NaBr và KBr. Sau phản ứng thu được muối NaCl và KCl, đồng thời thấy khối lượng muối giảm 4,45 gam. Xác định số mol chlorine đã tham gia phản ứng với 2 muối NaBr, KBr trên.
Câu 2 (1 điểm): X và Y là hai nguyên tố halogen thuộc hai chu kì liên tiếp trong bảng hệ thống tuần hoàn. Hỗn hợp A có chứa 2 muối của X và Y với sodium. Để kết tủa hoàn toàn 2,2 gam hỗn hợp A, phải dùng 150 mL dung dịch AgNO3 0,2M. Xác định hai nguyên tố X, Y.
Câu 3 (1 điểm): Hãy viết hai phương trình hóa học để chứng minh bromine có tính oxi hóa mạnh hơn iodine.